|
Hem A
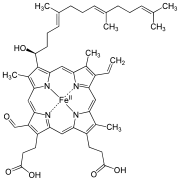
Hem A je druh hemu, čo je koordinačný komplex pozostávajúci z makrocyklického ligandu, patriaceho medzi porfyrín, ktorý cheluje atóm železa. Hem A je biomolekula, ktorá je prirodzene produkovaná mnohými organizmami. V roztoku má dichroicku zeleno-červenú farbu. Štruktúrne je podobný hemu B, ktorý je súčasťou hemoglobínu, červeného farbiva v krvi. Vzťah k ostatným hemomHem A sa líši od hemu B v tom, že metylová skupina na uhlíku 8 v kruhu je oxidovaná na formylovú skupinu a na vinylovú skupinu na uhlíku 2 je naviazaná hydroxyfarnezylová skupina, ktorá patrí medzi izoprenoidy. Hem A sa podobá na hem O, keďže obe majú farnezylovú skupinu na uhlíku 2, ale hem O nemá formylovú skupinu na uhlíku 8, namiesto ktorej má metylovú skupinu. Správna štruktúra hemu A, určená pomocou meraní NMR a IR spektroskopií, zistená pre redukované podobnu komplexu (s FeII), bola prvýkrát publikovaná v roku 1975.[1] Štruktúra bola potom potvrdená syntézou dimetylesteru hemu A bez atómu železa.[2] HistóriaHem A ako prvý izoloval nemecký biochemik Otto Warburg v roku 1951. Warburg takisto ukázal, že je to aktívna zložka integrálneho membránového metaloproteínu cytochróm c oxidázy.[3] StereochémiaPoslednou otázkou v štruktúre hemu A bolo presné geometrické usporiadanie na prvom uhlíku na pozícii 3 v kruhu I, teda uhlíku viazanom na hydroxylovú skupinu. V roku 2005 bolo ukázané, že konfigurácia tohto chirálneho uhlíku je S.[4] Podobne ako hem B, aj hem A je často naviazaný na apoproteín pomocou koordinačnej väzby medzi atómom železa a bočnými reťazcami zachovaných aminokyselín. V enzýme respiračného reťazca, cytochróm c oxidáze (CCO), je piatym ligandom hemu A, ktorý tvorí reakčné miesto pre kyslík, histidylová skupina.[5] Tento ligand (histidín) sa takisto bežne nachádza aj v iných hemoproteínoch, ako sú hemoglobín a myoglobín.  Ako kofaktorPríkladom metaloproteínu, ktorý viaže hem A, je cytochróm c oxidáza (CCO). Táto zložitá bielkovina obsahuje hem A na dvoch rôznych miestach, každý s inou finkciou. Jednotlivé miesta sú označované ako cytochróm a a cytochróm a3. Atóm železa v heme A v cytochróme a je hexakoordinovaný, teda viazaný na 6 ďalších atómov. V molekule cytochrómu a3 ja niekedy viazaný na 5 iných atómov (pentakoordinácia), čo necháva voľné šieste väzbové miesto, kam sa môže viazať molekula kyslíku (O2).[6] Okrem toho tento enzým viaže tri ióny mede, horčík, zinok a niekoľko iónov sodíka a draslíka. Predpokladá sa, že tieto dve hemové skupiny si vymieňajú elektróny medzi sebou, iónmi mede a proteínom cytochrómom c poblíž. Predpokladá sa, že formylová skupina a izoprenoidový bočný reťazec majú v CCO dôležitú úlohu v zachovávaní energie pri redukcii kyslíka. CCO je podľa všetkého zodpovedaná za zachovávanie energie redukcie dikyslíku tým, že pumpuje protóny do intermembránového priestoru mitochondrie. Tento predpoklad bol publikovaný skupinou S. Yoshikawovej.[7] Referencie
Pozri ajZdrojTento článok je čiastočný alebo úplný preklad článku Heme A na anglickej Wikipédii. |
||||||||||||||||||||||
Portal di Ensiklopedia Dunia