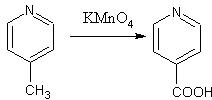|
Kalium permanganat
Kalium permanganat adalah suatu senyawa kimia anorganik dan obat-obatan. Sebagai obat senyawa ini digunakan untuk membersihkan luka dan dermatitis.[2] Senyawa ini memiliki rumus kimia KMnO4 dan merupakan garam yang mengandung ion K+ dan MnO−4. Senyawa ini merupakan agen pengoksidasi kuat. Ia larut dalam air menghasilkan larutan berwarna merah muda atau ungu yang intens, penguapan larutan ini meninggalkan kristal prismatik berwarna keunguan-hitam.[3] Pada tahun 2000, produksi di seluruh dunia diperkirakan mencapai 30,000 ton.[4] Dalam senyawa ini, mangan memiliki bilangan oksidasi +7. Senyawa ini termasuk dalam Model Daftar Obat Esensial WHO, obat yang paling penting dibutuhkan dalam sistem kesehatan dasar.[5] Biaya grosir di dunia berkembang adalah sekitar 0.01 USD per g.[6] Di Britania Raya jumlah tersebut membiayai NHS sekitar 1.33 pounds.[2] StrukturKMnO4 membentuk kristal ortorombik dengan konstanta: a = 910.5 pm, b = 572.0 pm, c = 742.5 pm. Motif keseluruhan hampir serupa dengan barium sulfat, yang karenanya membentuk larutan padat.[7] Dalam padatan (seperti pada larutan), masing-masing pusat MnO4− adalah tetrahedral. Jarak Mn–O adalah 1.62 Å.[8] PreparasiKalium permanganat diproduksi secara industri dari mangan dioksida, yang juga hadir sebagai mineral pirolusit. MnO2 melebur dengan kalium hidroksida dan dipanaskan dalam udara atau dengan sumber lain dari oksigen, seperti kalium nitrat atau kalium klorat.[4] Tahapan ini menghasilkan kalium manganat:
(Dengan natrium hidroksida, produk akhir bukanlah natrium manganat tapi senyawa Mn(V), yang merupakan salah satu alasan kalium permanganat lebih sering digunakan daripada natrium permanganat. Lebih jauh, garam kalium mengkristal lebih baik.[4]) Kalium manganat kemudian diubah menjadi permanganat melalui oksidasi elektrolit dalam media basa:
Metode lainWalaupun tidak penting secara komersial, kalium manganat dapat dioksidasi melalui klorin atau dengan disproporsionasi di bawah kondisi asam.[9] Reaksi oksidasi klorin adalah
Dan reaksi disproporsionasi yang diinduksi-asam dapat ditulis sebagai
Suatu asam lemah seperti asam karbonat cukup untuk reaksi ini:
Kalium permanganat mengkristal dari larutan reaksi pekat. Garam permanganat juga dapat dihasilkan dengan memperlakukan larutan ion Mn2+ dengan oksidan kuat seperti timbal dioksida (PbO2), natrium bismutat (NaBiO3), atau peroksidisulfat. Pengujian untuk kehadiran mangan memanfaatkan warna lembayung jelas dari permanganat yang dihasilkan oleh pereaksi tersebut. PenggunaanHampir semua aplikasi kalium permanganat memanfaatkan sifat mengoksidasinya.[4] Sebagai oksidan kuat yang tidak menghasilkan produk samping yang beracun, KMnO4 memiliki banyak kegunaan. AntiseptikSebagai oksidan, kalium permanganat dapat bertindak sebagai antiseptik. Misalnya, larutan encer senyawa ini digunakan untuk mengobati sariawan (radang), desinfektan untuk tangan dan pengobatan untuk pomfoliks, dermatitis,[10][11] dan infeksi jamur pada tangan atau kaki yang sifatnya ringan.[12] Pengolahan airKalium permanganat digunakan secara luas dalam industri pengolahan air. Hal ini digunakan sebagai bahan kimia regenerasi untuk menghilangkan besi dan hidrogen sulfida (bau telur busuk) dari air sumur melalui Filter "Manganese Greensand". "Pot-Perm" juga dapat diperoleh di toko peralatan kolam dan digunakan sebagai tambahan untuk menangani air limbah. Dalam sejarahnya ia digunakan untuk mensterilkan air minum.[13][14] Saat ini senyawa ini menemukan penerapannya dalam pengendalian organisme pengganggu seperti kerang zebra dalam pengumpulan dan pengolahan sistem air tawar.[15] Sintesis senyawa organik Selain penggunaannya dalam pengolahan air, aplikasi utama lainnya dari KMnO4 adalah sebagai pereaksi untuk sintesis senyawa organik.[16] Jumlah yang signifikan diperlukan untuk sintesis asam askorbat, kloramfenikol, sakarin, asam isonikotinat, dan asam pirazinoat.[4] Penggunaan analisisKalium permanganat dapat digunakan untuk secara kuantitatif menentukan bahan organik keseluruhan yang dapat teroksidasi dalam sampel air. Nilai yang telah ditentukan dikenal sebagai nilai permanganat. Dalam kimia analitik, larutan standar dari KMnO4 terkadang digunakan sebagai titran pengoksidasi untuk titrasi redoks (Permanganometri). Dalam cara yang terkait, ia digunakan sebagai pereaksi untuk menentukan bilangan Kappa dari pulp kayu. Untuk standardisasi larutan KMnO4, reduksi dengan asam oksalat sering digunakan.[17] Larutan asam berair dari KMnO4 digunakan untuk mengumpulkan gas merkuri dalam gas buang selama uji emisi sumber stasioner.[18] Dalam histologi, kalium permanganat digunakan sebagai agen pemutih.[19][20] Penggunaan lainKalium permanganat merupakan salah satu bahan kimia utama yang digunakan dalam film dan televisi industri untuk membuat kostum dan properti yang digunakan menjadi "berumur". Konversinya yang mudah menjadi MnO2 berwarna cokelat membuat tampilan "kuno" atau "seratus tahun" pada kain goni, tali, kayu, dan kaca.[21] Kalium permanganat telah digunakan dalam upaya untuk menginduksi aborsi di rumah. Insiden ini hanya mengakibatkan kerusakan vagina dari tindakan korosif bahan kimia tersebut, karena kalium permanganat terbukti tidak efektif dalam menghasilkan aborsi. FDA meningkatkan pembatasan hukum tentang bahan kimia tersebut dalam menanggapi penggunaannya sebagai abortifasien.[22] Keamanan dan penangananSebagai oksidator yang menghasilkan produk cokelat gelap MnO2, kalium permanganat dengan cepat mengotori hampir semua bahan organik seperti kulit, kertas, dan pakaian. Padatan KMnO4 adalah oksidator kuat, sehingga harus disimpan terpisah dari bahan yang dapat teroksidasi seperti kulit, kertas, dan pakaian. Reaksi dengan asam sulfat pekat menghasilkan mangan(VII) oksida (Mn2O7) yang sangat eksplosif. Ketika dalam bentuk padat, KMnO4 dicampurkan dengan gliserol murni atau alkohol sederhana lainnya akan menghasilkan reaksi pembakaran yang sangat keras.[23][24][25] Lihat pulaWikimedia Commons memiliki media mengenai Kalium permanganat. Referensi
Pranala luar
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||