|
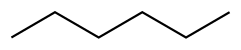
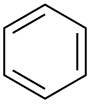
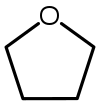
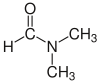
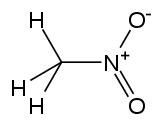
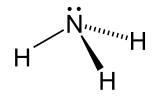
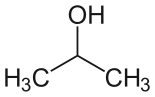
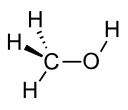
حلال (شیمی) حلّال (به انگلیسی: Solvent) مادهای است که حل شونده را در خود حل میکند و باعث ایجاد یک محلول میشود. حلال معمولاً یک ماده مایع است اما میتواند جامد، گاز یا یک سیال فوق بحرانی باشد. مقدار حل شونده ای که میتواند در حجم خاصی از حلال حل شود، با تغییر دما تغییر میکند. کاربرد اصلی حلالها در ساخت رنگ، پاک کنندههای رنگها و جوهرها، و خشکشویی است.[۱] کاربردهای خاص حلالهای آلی عبارتند از: استفاده در خشکشویی (به عنوان مثال تتراکلر اتیلن)، به عنوان مواد رقیق کننده رنگ (به عنوان مثال تولوئن و تربانتین)، به عنوان پاک کنندههای لاک ناخن و حلالهای چسب (استون، متیل استات، و اتیل استات)، در مواد پاک کننده لکهها (مانند هگزان، و اتر بنزن)، در مواد شوینده (ترپین مرکبات) و در عطرها (اتانول). آب یک حلال برای مولکولهای قطبی و متداولترین حلالی است که توسط موجودات زنده استفاده میشود. تمام یونها و پروتئینهای موجود در داخل سلول، در آب درون سلول حل میشوند. حلالها در صنایع شیمیایی، دارویی، نفت و گاز از جمله در سنتزهای شیمیایی و فرایندهای تصفیه، کاربردهای مختلفی پیدا میکنند. طبقهبندی حلالهاحلالها را میتوان بهطور کلی به دو دستۀ قطبی و غیر قطبی طبقهبندی کرد. یک مورد خاص جیوه است که محلولهای آن به نام آمالگام شناخته میشود. همچنین محلولهای فلزی دیگری نیز وجود دارند که در دمای اتاق مایع هستند. بهطور کلی، ثابت دی الکتریک حلال، مقیاسی تقریبی برای تعیین قطبیت حلال فراهم میکند. قطبیت بالای آب با ثابت دی الکترتیک بالای آن یعنی ۸۸ (در دمای ۰ درجه سلسیوس) نشان داده میشود.[۲] بهطور کلی حلالهایی با ثابت دی الکتریک کمتر از ۱۵ غیر قطبی در نظر گرفته میشوند.[۳] ثابت دی الکتریک تمایل حلال را برای لغو بخشی از قدرت میدان الکتریکی ذره باردار غوطه ور اندازهگیری میکند. این کاهش سپس با قدرت میدان ذره باردار در خلأ مقایسه میشود.[۳] به صورت ابتکاری، میتوان ثابت دی الکتریک یک حلال را توانایی آن در کاهش بار مؤثر داخلی املاح دانست. عموماً، ثابت دی الکتریک یک حلال پیشبینی کننده ای برای توانایی حلال در حل کردن ترکیبات یونی رایج، مانند نمکها است. آبمولکول آب (HOH) هم اتم هیدروژن و هم عامل OH- دارد؛ بنابراین هم باز و هم اسید و از این رو از لحاظ شیمیایی خنثی است. آب خالص یا آب مقطر اسیدها، قلیاها، نمکهای فلزی، صمغهای گیاهی، چسبهای قوی (مانند: سریشم، چسب کازیین، چسب نشاسته، چسب اوره فرمالیدیید و ملامین فرمالیدیید)، سریش، رنگ پلاستیک و الکلها را در خود حل میکند. حلالهای آلی (غیر آبی)هیدروژن و کربن عناصر اصلی این حلالها میباشند و شامل ۱۰ نوع میباشند:
حلالهای ترپنیاز قدیمیترین گونه حلالها میباشد که از درختان کاج و صنوبر به دست میآید و در گذشته مصرف بسیار زیادی در ساخت رنگهای ساختمانی، ورنیها و رنگهای هنری داشتهاند. اما امروزه به علت گرانقیمت بودن روش تهیه، حلالیت کم، کندی سرعت تبخیر و بوی تند، آنها با حلالهای هیدروکربنی که از مواد نفتی به دست میآیند و ارزان قیمت تر هستند جایگزین شدهاند. علاوه بر صنایع رنگسازی در هنر عکاسی نیز مورد استفاده قرار میگیرند و مشتمل بر تربانتین، دی پنتن، روغن کاج و صنوبر هستند. اتانولاتانول بیشترین کاربرد در آزمایشهای علمی را دارد. اما به علت قابلیت حل شدن در آب و اتر در رزینهای طبیعی مانند شلاک، پلی وینیل استات PVA، پلی وینیل بوتیرال، استرهای رزینی، رزینهای کیتونی و غیره به کار برده میشود. از اتانول به عنوان حلال، میکروب کش، ضدیخ، سوخت، مادهٔ کسلکننده در صنایع پتروشیمی، داروسازی و غیره استفاده میشود.[۴] حلالهای چندجزئیحلال های چند جزئی پس از جنگ جهانی دوم در اتحاد جماهیر شوروی ظاهر شدند و امروزه همچنان در سایر کشورها مورد استفاده و تولید قرار میگیرند. حلالها
تینرها (رقیق کنندهها)
خواص فیزیکیجدول خصوصیات حلالهای رایجحلالها به سه گروه غیرقطبی، قطبی اپروتیک، و قطبی پروتیک تقسیمبندی شدهاند. خواص حلالهایی که بیشتر از آب هستند با حروف پررنگ مشخص شدهاند.
انجمن شیمی آمریکا ابزاری را برای انتخاب حلالها بر اساس تجزیه و تحلیل مولفههای اصلی خواص حلال ارائه میدهد.[۱۱] منابع
Information related to حلال (شیمی) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia