|
Nitril fluorida
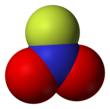
Nitril fluorida, NO2F, adalah gas tak berwarna dan oksidator kuat, yang digunakan sebagai zat fluorinasi[1] dan telah diusulkan sebagai oksidator dalam propelan roket (meskipun tidak pernah terbang). Ia adalah sepesies molekuler, bukan ionik, ditunjukkan dengan titik didihnya yang rendah. Strukturnya menggambarkan nitrogen planar dengan panjang ikatan N-F yang pendek (hanya 135 pm).[2] PembuatanHenri Moissan dan Lebeau melakukan preparasi nitril fluorida pada tahun 1905 melalui fluorinasi nitrogen dioksida. Reaksi ini sangat eksotermik, yang menghasilkan produk terkontaminasi. Metode paling sederhana menghindari gas fluor tetapi menggunakan kobalt(III) fluorida:[3] CoF2 dapat diregenerasi menjadi CoF3. Telah dijelaskan pula metode lainnya.[4] Sifat termodinamikaSifat termodinamika gas ini telah ditentukan menggunakan spektroskopi IR dan Raman[5] Panas pembentukan standar FNO2 adalah -19 ± 2 kcal/mol.
Ini dapat diatribusikan sebagai “energi reorganisasi” radikal NO2; yaitu, radikal NO2 dalam FNO2 kurang stabil daripada molekul NO2 bebas. Secara kualitatif, elektron ganjil “naik” dalam ikatan N-F membentuk ikatan tiga-elektron beresonansi dalam NO2 bebas, sehingga menstabilkan molekul dengan mendapatkan 18 kkal.[5] ReaksiNitril fluorida dapat digunakan untuk menyiapkan senyawa nitro organik dan ester nitrat. Lihat jugaReferensi
Pranala luar |
||||||||||||||||||||||||||||||||||||||||||||||||||||