|
Sulfonasi aromatik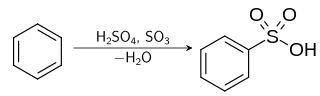 Sulfonasi adalah suatu reaksi organik di mana suatu atom hidrogen pada hidrokarbon aromatik digantikan oleh suatu asam sulfonat (SO3H) dalam suatu substitusi elektrofilik aromatik.[1] Asam aril sulfonat digunakan sebagai bahan utama dari detergen.[2] Bahan ini juga digunakan sebagai bahan dasar dari pewarna dan obat-obatan. Mekanisme reaksi Mekanisme reaksi sulfonasi melibatkan pemanasan senyawa aromatik dengan asam sulfat:[3]
Sulfur trioksida atau derivat terprotonasinya merupakan elektrofil sebenarnya dalam substitusi elektrofilik aromatik. Untuk menuju kesetimbangan, agen pendehidrasi seperti tionil klorida dapat ditambahkan.
Asam klorosulfat dapat pula menjadi agen pendehidrasi yang efektif:
Berbeda dengan nitrasi aromatik dan kebanyakan substitusi elektrofilik aromatik lainnya reaksi ini merupakan reaksi bolak-balik (reversibel). Sulfonasi berlangsung dalam kondisi asam pekat dan desulfonasi dilakukan dalam asam encer berair yang panas. Kedapatbalikan ini sangat berguna dalam melindungi sistem aromatik karena kedapatbalikan tersebut.  Metode khususBanyak metode telah dikembangkan untuk memasukkan gugus sulfonat selain dari arah sulfonasi. Reaksi Piria Salah satu reaksi nama yang klasik adalah reaksi Piria (R. Piria, 1851) yang mana nitrobenzena direaksikan dengan suatu logam bisulfit membentuk asam aminosulfonat sebagai hasil penggabungan reduksi gugus nitro dan sulfonasi.[4][5] Proses sulfonasi pada banDalam proses sulfonasi ban karet (1917),[6] uap benzena dituntun melalui suatu bejana yang mengandung 90% asam sulfat dan suhu yang meningkat dari 100 menjadi 180 °C. Air dan benzena terus dihilangkan dalam kondensor dan lapisan benzena diberikan sebagai umpan balik kepada bejana. Dengan cara ini diperoleh rendemen sebesar 80%.
Aplikasi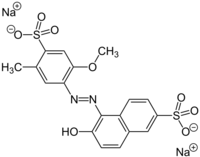 Asam sulfonat aromatik adalah zat antara dalam penyiapan pewarna dan banyak obat-obatan. Sulfonasi dari anilin mengarah kepada sekelompok besar obat sulfa. Sulfonasi dari polistirena digunakan untuk membuat natrium polistirena sulfonat, suatu resin pertukaran ion yang umum untuk pelunakan air.
Reaksi aril sulfonatSebagai gugus fungsional, asam sulfonat aril menunjukkan dua reaksi yang berbeda:
Reaktivitas ini dimanfaatkan dalam konversi regiospesifik dari 2-klorotoluena melalui klorinasi p-toluenasulfonat, diikuti oleh hidrolisis zat antara.
lihat pulaReferensi
|




