|
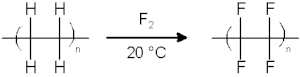
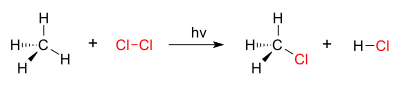
Halogenasi Halogenasi adalah suatu reaksi kimia yang melibatkan penambahan satu atau lebih halogen pada suatu senyawa atau material. Dehalogenasi adalah kebalikan dari halogenasi dan menghasilkan pelepasan halogen dari suatu molekul.[1] Jalur reaksi dan stoikiometri halogenasi bergantung pada struktur dan gugus fungsional pada substrat organik, serta pada halogen yang spesifik. Senyawa anorganik seperti logam juga mengalami reaksi halogenasi. Kimia organikHalogenasi berdasarkan jenis halogenFluorinasiSenyawa organik, jenuh dan tak jenuh, mudah bereaksi, biasanya eksplosif, dengan fluor. Fluorinasi dengan fluor elemental (F2) memerlukan kondisi dan peralatan yang sangat khusus. Banyak senyawa organik penting secara komersial difluorinasi secara elektrokimia menggunakan hidrogen fluorida sebagai sumber fluor. Metode ini disebut fluorinasi elektrokimia. Selain F2 dan sejenisnya secara elektrokimia yang dihasilkan, berbagai reagen pengfluorinasi yang dikenal seperti xenon difluorida dan kobalt(III) fluorida. KlorinasiKlorinasi secara umum sangat eksotermik. Baik senyawa jenuh dan tak jenuh bereaksi secara langsung dengan klor, yang pertama biasanya membutuhkan cahaya UV untuk memulai homolisis klor. Klorinasi dilakukan dalam skala besar secara industri; proses utama termasuk rute pada 1,2-dikloroetana (prekursor bagi PVC), serta beragam etana terklorinasi, sebagai pelarut. BrominasiBrominasi lebih selektif dibandingkan klorinasi karena reaksinya yang kurang eksotermik. Brominasi umumnya dilakukan melalui adisi Br2 pada alkena. Sebagai contoh brominasi adalah sintesis organik pada halotana anestetik dari trikloroetilena:[2] Senyawa organobromin merupakan organohalida yang paling umum di alam. Penbentukannya dikatalisis oleh enzim bromoperoksidase yang memanfaatkan bromida dikombinasikan dengan oksigen sebagai oksidan. Lautan diperkirakan melepaskan 1-2 juta ton bromoform dan 56.000 ton bromometana per tahun.[3] IodinasiIodin adalah halogen paling reaktif dan enggan untuk bereaksi dengan sebagian besar senyawa organik. Penambahan iodin pada alkena merupakan dasar dari metode analisis yang disebut bilangan iodin, ukuran tingkat ketidakjenuhan pada lemak. Reaksi iodoform melibatkan degradasi metil keton. Kimia anorganikSeluruh unsur kimia selain argon, neon, dan helium membentuk fluorida melalui reaksi langsung dengan fluor. Klor agak lebih selektif, tapi masih bereaksi dengan kebanyakan logam dan non logam yang lebih berat. Mengikuti tren biasanya, brom kurang reaktif dan iodin paling tidak dari semua. Dari sekian banyak reaksi yang mungkin, penggambarannya adalah pembentukan emas (III) klorida melalui klorinasi emas. Klorinasi logam biasanya tidak terlalu penting secara industri karena klorida lebih mudah dibuat dari oksida dan halida hidrogen. Klorinasi senyawa anorganik dipraktikkan pada skala yang relatif besar, untuk memproduksi fosfor triklorida dan sulfur monoklorida.[4] Dehalogenasi kimiaDehalogenasi kimia adalah suatu perlakuan untuk menghilangkan halogen dari bahan kimia berbahaya atau area terkontaminasi dengan membuat bahan tersebut kurang toksik. Terdapat dua tipe dehalogenasi: dehalogenasi glikolat dan dekomposisi yang di-katalisis oleh basa.[5] Lihat pulaWikiquote memiliki koleksi kutipan yang berkaitan dengan: Halogenasi.
Referensi
Pranala luar
|