|
Sel elektrokimia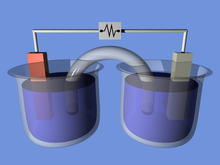 Sel elektrokimia adalah suatu alat yang mampu menghasilkan energi listrik dari reaksi kimia atau menggunakan energi listrik untuk menjalankan reaksi kimia. Sel elektrokimia yang menghasilkan arus listrik disebut sel Volta atau sel Galvani dan sel yang menghasilkan reaksi kimia, melalui elektrolisis misalnya, disebut sel elektrolisis.[1][2] Contoh sel Galvani yang umum adalah sel 1,5 volt standar[3] yang banyak digunakan. Suatu baterai terdiri dari satu atau lebih sel, yang terhubung baik dalam pola paralel, seri atau seri-dan-paralel. Sel elektrokimia tersusun dari dua material penghantar atau konduktor listrik yang disebut dengan katode dan anode. Kedua material penghantar ini disebut dengan elektrode. Sel elektrolisis Sel elektrolisis adalah sel elektrokimia yang mendorong reaksi redoks non-spontan melalui penerapan energi listrik. Mereka sering digunakan untuk menguraikan senyawa kimia, dalam proses yang disebut elektrolisis – kata Yunani lisis berarti untuk memutuskan. Contoh penting dari elektrolisis adalah dekomposisi air menjadi hidrogen dan oksigen, dan bauksit menjadi aluminium dan bahan kimia lainnya. Elektroplating (mis. tembaga, perak, nikel atau kromium) dilakukan menggunakan sel elektrolisis. Elektrolisis adalah teknik yang menggunakan arus listrik searah (DC). Sel GalvaniSel Galvani, atau sel Volta, masing-masing dinamai Luigi Galvani, atau Alessandro Volta, adalah sel elektrokimia yang memperoleh energi listrik dari reaksi redoks spontan yang terjadi di dalam sel. Pada umumnya terdiri dari dua logam berbeda yang dihubungkan oleh jembatan garam, atau setengah-sel individu yang dipisahkan oleh membran berpori. Volta adalah penemu tumpukan volta, baterai listrik pertama. Dalam penggunaan umum, kata "baterai" sudah termasuk sel galvanik tunggal, namun baterai yang sebenarnya terdiri dari banyak sel.[4] Lihat pulaReferensi
|
