|
Nikel Raney Nikel Raney adalah sejenis katalis padat yang terdiri dari butiran halus aloi nikel-alumunium yang digunakan dalam berbagai proses industri. Ia dikembangkan pada tahun 1926 oleh insinyur Amerika Murray Raney[1] sebagai katalis alternatif untuk hidrogenasi minyak nabati pada berbagai proses industri. Baru-baru ini, ia digunakan sebagai katalis heterogen pada berbagai macam sintesis organik, umumnya untuk reaksi hidrogenasi. Nikel Raney dihasilkan ketika aloi nikel-aluminium diberikan natrium hidroksida pekat. Perlakuan yang disebut "aktivasi" ini melarutkan keluar kebanyakan aluminium dalam aloi tersebut. Struktur berpori-pori yang ditinggalkan mempunyai luas permukaan yang besar, menyebabkan tingginya aktivitas katalitik katalis ini. Katalis ini pada umumnya mengandung 85% nikel berdasarkan massa, berkorespondensi dengan dua atom nikel untuk setiap atom aluminium. Aluminium membantu menjaga struktur pori katalis ini secara keseluruhan. Karena Raney merupakan merek dagang W. R. Grace and Company, hanya produk-produk yang diproduksi oleh divisi Grace Davison perusahaan itu saja yang boleh disebut sebagai "Nikel Raney". Nama alternatif "katalis kerangka" atau "katalis logam-spons" digunakan untuk merujuk pada katalis yang mempunyai sifat-sifat fisika dan kimia yang mirip dengan nikel Raney. PembuatanPembuatan aloiAloi dibuat secara komersial dengan melelehkan logam aktif (dalam kasus ini adalah nikel, walaupun besi dan tembaga juga dapat menghasilkan katalis yang bersifat sama) dan aluminium dalam krus, kemudian lelehan yang dihasilkan didinginkan (quenching) dan selanjutnya ditumbuk menjadi bubuk halus[2] Bubuk ini kemudian dapat dicadar untuk ukuran partikel tertentu tergantung pada aplikasi yang digunakan. Komposisi aloi awal sangatlah penting karena proses pendinginan menghasilkan berbagai fase Ni/Al yang berbeda-beda yang memiliki sifat-sifat pelindian (leaching) yang berbeda pula. Hal ini kemudian akan mengakibatkan perbedaan porositas produk akhir. Aloi awal yang umumnya digunakan dalam industri mengandung sejumlah berat nikel dan aluminium yang sama, dan secara kebetulan merupakan rasio yang digunakan oleh Murray Raney dalam penemuan katalis ini. Selama proses pendinginan, sejumlah kecil logam ketiga, seperti seng atau kromium, dapat ditambahkan. Hal ini dilakukan untuk meningkatkan aktivitas katalitik, sehingga logam ketiga ini disebut sebagai "promotor".[2] Penambahan promotor ini akan mengubah aloi dan diagram fasenya menjadi diagram fase aloi terner, mengakibatkan perbedaan sifat-sifat pendinginan dan pelindian selama proses aktivasi.  AktivasiStruktur pori katalis ini disebabkan oleh pelepasan aluminium dari partikel aloi dengan menggunakan larutan natrium hidroksida pekat. Reaksi pelindian yang disederhanakan adalah sebagai berikut:
Pembentukan natrium aluminat (Na[Al(OH)4]) memerlukan konsentrasi natrium hidroksida yang tinggi agar pembentukan aluminium hidroksida yang mengendap sebagai bayerit dapat dihindari.[2] Oleh karena itu, larutan dengan konsentrasi sampai dengan 5 molar digunakan. Bayerit akan menyebabkan penyumbatan pori-pori yang dihasilkan selama pelindian, sehingga menurunkan luas permukaan katalis, yang pada akhirnya menurunkan efisiensi dan aktivitas katalis. Temperatur yang digunakan untuk melindi aloi memengaruhi sifat-sifat permukaan katalis. Temperatur yang umumnya digunakan berkisar dari 70 sampai 100 °C. Luas permukaan nikel Raney (dan katalis kerangka secara umum) cenderung menurun seiring dengan peningkatan temperatur pelindian.[3] Hal ini dikarenakan penataan ulang struktur di dalam aloi yang dapat dianggap beranalogi dengan proses pelengketan, di mana ligamen aloi akan mulai melekat satu sama lainnya pada temperatur yang lebih tinggi, menyebabkan hilangnya struktur pori. Sebelum disimpan, katalis dapat dibersihkan dengan air suling pada temperatur ambien untuk melepaskan sekelumit natrium aluminat yang tertinggal. Air bebas oksigen dipilih sebagai media penyimpanan untuk menghindri oksidasi katalis yang akan menurunkan aktivitas katalitik katalis.[2]  Sifat-sifatSecara makroskopis, nikel Raney terlihat sebagai bubuk halus yang berwarna kelabu. Secara mikroskopis, setiap partikel pada bubuk ini terlihat seperti jaring tiga dimensi, dengan ukuran dan bentuk pori-pori yang tidak tentu yang dibentuk selama proses pelindian. Nikel Raney secara struktural dan termal stabil, serta mempunyai luas permukaan BET yang besar. Sifat-sifat ini merupakan akibat langsung dari proses aktivasi, yang juga mengakibatkan aktivitas katalitik katalis yang relatif tinggi. Selama proses aktivasi, aluminium dilindi keluar dari fase NiAl3 dan Ni2Al3 yang terdapat pada aloi, sedangkan aluminium yang tersisa berada dalam bentuk NiAl. Pengeluaran aluminium pada beberapa fase tertentu dikenal sebagai "pelindian selektif". Dapat ditunjukkan bahwa fase NiAl berkontribusi dalam menjaga stabilitas struktural dan termal katalis. Oleh sebab itu, katalis ini cukup resistan terhadap dekomposisi.[3] Resistansi ini mengizinkan nikel Raney untuk disimpan dan digunakan kembali untuk beberapa periode waktu; namun, nikel Raney yang baru dibuat biasanya lebih dipilih untuk digunakan dalam laboratorium. Karenanya, nikel Raney komersial tersedia dalam bentuk "aktif" dan "takaktif". Luas permukaan katalis biasanya ditentukan dengan pengukuran BET menggunakan gas yang akan secara selektif terserap pada permukaan logam (misalnya hidrogen). Dengan menggunakan pengukuran ini, ditemukan bahwa hampir semua luas permukaan yang terpajan (exposed) pada partikel katalis mempunyai nikel pada permukaannya.[2] Oleh karena nikel merupakan logam aktif katalis, luas permukaan nikel yang besar mengimplikasikan terdapatnya luas permukaan yang besar yang tersedia untuk sebuah reaksi untuk berjalan secara bersamaan, merefleksikan peningkatan aktivitas katalitik. Nikel Raney yang tersedia secara komersial memiliki luas permukaan rata-rata 100 m² per gram katalis.[2] Aktivitas katalitik yang tinggi, diikuti dengan fakta bahwa hidrogen terserap ke dalam pori-pori katalis selama aktivasi, menjadikan nikel Raney sebagai katalis yang berguna untuk banyak reaksi hidrogenasi. Stabilitas termal dan strukturalnya (tidak terurai pada temperatur yang tinggi) mengizinkan penggunaan katalis ini pada kisaran kondisi reaksi yang luas. Selain itu, solubilitas nikel Raney boleh diabaikan pada kebanyakan pelarut laboratorium umum, terkecuali pada asam mineral seperti asam klorida, dan densitasnya yang relatif tinggi (antara 6 sampai 7 g/cm³) juga memfasilitasi pemisahan fase cair setelah reaksinya selesai. AplikasiNikel Raney digunakan dalam sejumlah besar proses industri dan dalam sintesis organik karena ia stabil dan mempunyai aktivitas katalitik yang tinggi pada temperatur kamar.[2][4][5] Aplikasi industriContoh praktis penggunaan nikel Raney dalam industri ditunjukkan pada reaksi di bawah ini, di mana benzena direduksi menjadi sikloheksana. Reduksi struktur heksa cincin benzena sangatlah sulit dicapai jika menggunakan proses kimia lainnya, namun hal ini dapat dicapai secara efektif menggunakan nikel Raney. Katalis heterogen lainnya, seperti katalis yang menggunaan unsur-unsur golongan platinum dapat digunakan untuk mencapai hasil yang sama, namun penggunaan katalis jenis ini lebih mahal dan lebih sulit diproduksi daripada nikel Raney. Setelah reaksi ini, sikloheksana dapat digunakan untuk sintesis asam adipat, bahan baku untuk produksi industri poliamida seperti nilon..[6] 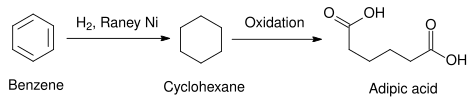 Aplikasi pada sintesis organikDesulfurisasiKegunaan utama nikel Raney pada sintesis organik adalah desulfurisasi. Sebagai contoh, tioasetal akan direduksi menjadi hidrokarbon:[6]  Tiol,[7] and sulfida[8] dapat dilepaskan dari senyawa-senyawa alifatik, aromatik, dan heteroatom. Nikel Raney juga dapat melepaskan sulfur dari tiofena untuk menghasilkan alkana jenuh.[9]  Reduksi gugus fungsiNikel Raney umumnya digunakan dalam reduksi senyawa-senyawa yang mengandung ikatan ganda, seperti alkuna, alkena,[10] nitril,[11] diena, aromatik[12] dan karbonil. Selain itu, nikel Raney juga akan mereduksi ikatan heteroatom-heteratom seperti hidrazina,[13] gugus nitro, dan nitrosamina.[14] (Informasi lebih lanjut, silakan lihat Reduksi senyawa nitro.) Ia juga digunakan dalam reduksi alkilasi amina[15] dan aminasi alkohol. Ketika mereduksi ikatan ganda karbon-karbon, nikel Raney akan melakukan adisi sin hidrogen.[6] Keamanan  Dikarenakan luas permukaan dan volume hidrogen gas yang dapat ditampung besar, nikel Raney yang teraktivasi dan kering adalah bahan yang bersifat piroforik yang harus ditangani di bawah atmosfer inert. Nikel Raney umumnya disuplai sebagai 50% bubur dalam air. Hindarkan nikel Raney dari kontak udara. Bahkan setelah reaksi, nikel Raney masih mengandung sejumlah kadar gas hidrogen yang signifikan, dan akan menyala seketika berkontak dengan udara. Nikel raney akan menghasilkan asap yang berbahaya ketika terbakar, sehingga penggunaan masker gas sangat direkomendasikan ketika memadamkan api yang disebabkan oleh pembakaran katalis. Selain itu, paparan akut terhadap nikel Raney akan menyebabkan iritasi saluran pernapasan dan rongga hidung, dan menyebabkan fibrosis paru jika dihirup. Penelanan akan menyebabkan kejang-kejang dan gangguan usus. Ia juga dapat menyebabkan iritasi mata dan kulit. Paparan kronis akan menyebabkan pneumonitis dan tanda-tanda sensitisasi terhadap nikel seperti ruam kulit.[16] Nikel juga diklasifikasikan kemungkinan bersifat karsinogen dan teratogen terhadap manusia oleh IARC (Group 2B, EU category 3), sedangkan inhalasi partikel aluminium oksida diasosiasikan dengan penyakit Shaver. Diperlukan kehati-hatian yang sangat dalam menangani bahan-bahan ini selama proses pembuatan nikel Raney dalam laboratorium. Selain itu, aktivasi nikel Raney menghasilkan gas hidrogen yang cukup besar sebagai produk samping, yang juga sangat mudah terbakar.[16] Referensi
Bacaan lebih lanjut
Pranala luar
|
