|
Etil asetat
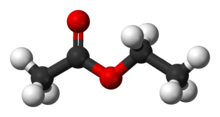
Etil asetat adalah senyawa organik dengan rumus CH3CH2OC(O)CH3. Senyawa ini merupakan ester dari etanol dan asam asetat. Senyawa ini berwujud cairan tak berwarna, memiliki aroma khas dan digunakan sebagai perekat[3]. Senyawa ini sering disingkat EtOAc, dengan Et mewakili gugus etil dan OAc mewakili asetat. Etil asetat diproduksi dalam skala besar sebagai pelarut. Sifat kimia dan fisikaEtil asetat adalah pelarut polar menengah yang volatil (mudah menguap), tidak beracun, dan tidak higroskopis. Etil asetat merupakan penerima ikatan hidrogen yang lemah, dan bukan suatu donor ikatan hidrogen karena tidak adanya proton yang bersifat asam (yaitu hidrogen yang terikat pada atom elektronegatif seperti fluor, oksigen, dan nitrogen. Etil asetat dapat melarutkan air hingga 3%, dan larut dalam air hingga kelarutan 8% pada suhu kamar. Kelarutannya meningkat pada suhu yang lebih tinggi. Namun, senyawa ini tidak stabil dalam air yang mengandung basa atau asam. SintesisEtil asetat disintesis melalui reaksi esterifikasi Fischer dari asam asetat dan etanol dan hasilnya beraroma jeruk (perisa sintesis), biasanya dalam sintesis disertai katalis asam seperti asam sulfat.
Reaksi di atas merupakan reaksi reversibel dan menghasilkan suatu kesetimbangan kimia. Karena itu, rasio hasil dari reaksi di atas menjadi rendah jika air yang terbentuk tidak dipisahkan. Di laboratorium, produk etil asetat yang terbentuk dapat dipisahkan dari air dengan menggunakan aparatus Dean-Stark. ReaksiEtil asetat dapat dihidrolisis pada keadaan asam atau basa menghasilkan asam asetat dan etanol kembali. Katalis asam seperti asam sulfat dapat menghambat hidrolisis karena berlangsungnya reaksi kebalikan hidrolisis yaitu esterifikasi Fischer. Untuk memperoleh rasio hasil yang tinggi, biasanya digunakan basa kuat dengan proporsi stoikiometris, misalnya natrium hidroksida. Reaksi ini menghasilkan etanol dan natrium asetat, yang tidak dapat bereaksi lagi dengan etanol:
Referensi
Pranala luar
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||