|
Bikarbonat
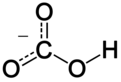
Dalam kimia anorganik, bikarbonat (tatanama yang direkomendasikan oleh IUPAC: hidrogen karbonat[2]) adalah bentuk antara dari deprotonasi asam karbonat. Ia merupakan anion poliatomik dengan rumus kimia HCO−3. Bikarbonat mempunyai peran biokimia penting dalam sistem pendaparan pH fisiologis.[3] Istilah "bikarbonat" diberikan pada tahun 1814 oleh kimiawan Inggris William Hyde Wollaston.[4] Awalan "bi" dalam "bikarbonat berasal dari sistem penamaan kuno dan berdasarkan pengamatan bahwa terdapat dua karbonat (CO2−3) per ion natrium dalam natrium bikarbonat (NaHCO3) dan bikarbonat lain kecuali dalam natrium karbonat (Na2CO3) dan karbonat lainnya.[5] Nama tersebut masih lestari sebagai nama trivial. Sifat kimiaIon bikarbonat (ion hidrogenkarbonat) adalah suatu anion dengan rumus empiris HCO−3 dan massa molekul 61,01 dalton; ia terdiri dari satu atom karbon sebagai pusat yang dikelilingi oleh tiga atom oksigen dalam penataan trigonal planar; dengan atom hidrogen terikat pada salah satu atom oksigen. Ion karbonat isoelektronik dengan asam nitrat HNO3. Ion bikarbonat membawa muatan formal negatif satu dan merupakan basa konjugat dari asam karbonat H2CO3; sekaligus, merupakan asam konjugat dari CO2−3, ion karbonat, seperti ditunjukkan dalam reaksi kesetimbangan berikut: Garam bikarbonat terbentuk ketika ion bermuatan positif terikat pada atom oksigen bermuatan negatif dari bikarbonat, membentuk senyawa ionik. Banyak bikarbonat mudah larut dalam air pada suhu dan tekanan standar; secara khusus, natrium bikarbonat memberi kontribusi pada padatan terlarut total, sebuah parameter umum untuk menguji kualitas air. Peran fisiologis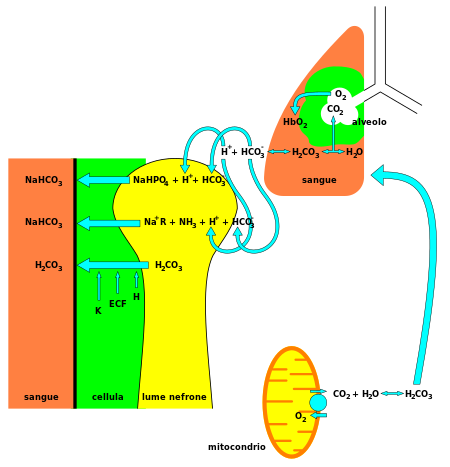 Bikarbonat (HCO−3) bersifat alkalis, dan merupakan komponen vital pada sistem pendaparan pH[3] tubuh manusia (mempertahankan homeostatis asam-basa). Sebanyak 70–75% CO2 dalam tubuh dikonversi menjadi asam karbonat (H2CO3), yang dapat diubah dengan cepat menjadi bikarbonat. Dengan asam karbonat sebagai spesies intermediat pusat, bikarbonat - yang berkonjugasi dengan air, ion hidrogen, dan karbon dioksida - membentuk sitem dapar, yang dijaga pada kesetimbangan volatil[3] yang diperlukan untuk menjaga resistensi perubahan pH ke kedua arah, baik menuju asam dan basa. Hal ini penting untuk melindungi jaringan sistem saraf pusat. JIka pH berubah terlalu jauh dari kisaran normal akan menghasilkan bencana (lihat asidosis atau alkalosis). Bikarbonat juga bertindak mengatur pH dalam usus kecil. Ia dibebaskan dari pankreas sebagai tanggapan terhadap hormon sekretin untuk menetralkan bubur lambung (chyme) yang masuk ke kusus besar dari lambung.[6] Bikarbonat di lingkunganBikarbonat merupakan bentuk dominan dari karbon anorganik terlarut dalam air laut,[7] dan dalam sebagian besar air tawar. Dengan demikian, ia adalah penyerap penting dalam siklus karbon. Dalam ekologi air tawar, aktivitas fotosintesis yang kuat oleh tanaman air tawar di siang hari melepaskan gas oksigen ke dalam air dan pada saat bersamaan menghasilkan ion bikarbonat. Ini menggeser pH ke atas sampai dalam keadaan tertentu tingkat alkalinitas bisa menjadi racun bagi beberapa organisme atau dapat membuat unsur kimia lainnya, seperti amonia, menjadi beracun. Dalam kegelapan, ketika tidak terjadi fotosintesis, proses respirasi melepaskan karbon dioksida, dan tidak ada ion bikarbonat baru yang dihasilkan, yang mengakibatkan penurunan pH yang cepat. Kegunaan lainGaram ion bikarbonat yang paling umum adalah natrium bikarbonat, NaHCO3, yang biasa dikenal sebagai soda kue. Bila dipanaskan atau terkena asam seperti asam asetat (cuka), natrium bikarbonat membebaskan karbon dioksida. Ini digunakan sebagai bahan pengembang dalam baking. Aliran ion bikarbonat dari batuan yang disebabkan oleh asam karbonat dalam air hujan merupakan bagian penting dari siklus karbon. Bikarbonat juga banyak berperan dalam sistem pencernaan. Ia meningkatkan pH internal lambung, setelah cairan pencernaan yang sangat asam selesai mencerna makanan. Amonium bikarbonat digunakan dalam pembuatan biskuit digestif. DiagnostikaDalam kedokteran diagnostik, nilai darah bikarbonat adalah salah satu dari beberapa indikator keadaan fisiologi asam-basa dalam tubuh. Ia diukur, bersama dengan karbon dioksida, klorida, kalium, dan natrium, untuk menilai tingkat elektrolit dalam uji panel elektrolit (yang memiliki Current Procedural Terminology, CPT, kode 80051). Parameter konsentrasi bikarbonat standard (SBCe) adalah konsentrasi bikarbonat dalam darah pada PaCO2 sebesar 40 mmHg (5,33 kPa), saturasi oksigen penuh dan 36 °C.[8] Senyawa bikarbonat
Lihat jugaReferensi
Pranala luarLihat entri bikarbonat di kamus bebas Wiktionary. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||