|
Asam konjugat dan basa konjugat
Asam konjugasi menurut teori asam-basa Brønsted–Lowry dibentuk oleh penerimaan proton (H+) oleh basa; dalam kata lain, asam konjugasi adalah basa yang telah memperoleh ion hidrogen. Di sisi lain, basa konjugasi adalah yang tersisa setelah asam telah memberikan proton dalam suatu reaksi kimia. Maka dari itu, basa konjugasi dibentuk oleh pelepasan proton dari suatu asam.[1] Asam konjugasi dapat digambarkan dengan menggunakan reaksi kimia berikut:
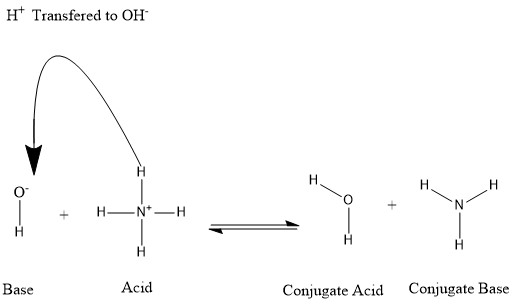
Johannes Nicolaus Brønsted dan Martin Lowry memperkenalkan teori Brønsted–Lowry, yang mengusulkan bahwa senyawa manapun yang dapat menyerahkan proton kepada senyawa lain adalah asam, sementara senyawa yang menerima proton adalah basa.[2] Kation dapat menjadi asam konjugasi, dan anion dapat menjadi basa konjugasi, tergantung pada unsur yang digunakan dan reaksi asam-basa mana yang berlangsung. Reaksi asam-basaDalam suatu reaksi asam-basa, asam dan basa membentuk basa konjugasi dan asam konjugasi: Konjugasi terbentuk saat asam kehilangan proton hidrogen atau basa memperoleh proton hidrogen. Lihat gambar berikut: Dapat dikatakan bahwa molekul air adalah asam konjugasi ion hidroksida setelah hidroksida mendapat proton hidrogen yang diberikan oleh amonium. Di sisi lain, amonia adalah basa konjugasi untuk amonium asam setelah amonium telah menyerahkan ion hidrogen untuk menghasilkan molekul air. OH- dapat dianggap sebagai basa konjugasi H2O, karena molekul air menyerahkan proton untuk menghasilkan NH+4 dalam reaksi ke arah sebaliknya, yang merupakan proses yang sangat sering terjadi di alam karena basa NH3 lebih kuat dari ion hidroksida. Berdasarkan informasi ini, dapat dilihat bahwa istilah "asam", "basa", "asam konjugasi" dan "basa konjugasi" bukanlah istilah yang berlaku tetap untuk suatu unsur kimia, tetapi dapat berganti-ganti tergantung pada situasinya. Kekuatan konjugasiKekuatan suatu asam konjugasi proporsional dengan tetapan disosiasinya. Jika suatu asam konjugasi merupakan suatu asam kuat, disosiasinya akan memiliki tetapan kesetimbangan yang lebih tinggi. Kekuatan suatu basa konjugasi dapat dilihat dari kecenderungannya untuk "menarik" proton hidrogen. Jika suatu basa konjugasi merupakan suatu basa yang kuat, basa itu akan "menahan" proton hidrogen saat larut dan asamnya tidak akan terurai. Jika suatu spesies kimia dapat digolongkan sebagai asam lemah, basa konjugasinya akan menjadi basa yang kuat. Hal ini dapat diamati dari reaksi amonia (basa yang relatif kuat) dengan air. Reaksi ini berlangsung hingga sebagian besar amonia telah berubah menjadi amonium. Pergeseran kesetimbangan kimia reaksi ke kanan menunjukkan bahwa amonium tidak mudah terurai di air (asam lemah), dan basa konjugasinya lebih kuat daripada ion hidroksida. Di sisi lain, jika suatu spesies kimia dapat digolongkan sebagai asam kuat, basa konjugasinya akan menjadi lemah. Contohnya adalah penguraian asam klorida HCl di air. HCl merupakan asam yang kuat (terurai dalam air), sehingga (Cl−) akan menjadi basa konjugasi yang lemah. Maka dari itu, sebagian besar H+ akan ada dalam bentuk ion hidronium H3O+ dan tidak terikat dengan anion Cl, dan basa konjugasinya lebih lemah daripada molekul air. Singkatnya, semakin kuat suatu asam atau basa, semakin lemah konjugasinya. Menemukan pasangan asam-basa konjugasiAsam dan basa konjugasi serta basa dan asam konjugasi dikenal sebagai pasangan konjugasi. Saat mencari konjugasi asam atau basa, perlu dilihat reaktan suatu persamaan kimia. Dalam kasus ini, reaktannya adalah asam dan basa. Untuk mengidentifikasi asam konjugasi, cari pasangan senyawa yang terkait. Reaksi asam-basa dapat dilihat dari sisi sebelum dan sesudah. Reaktan merupakan bagian sebelum dalam persamaan, sementara hasilnya ada di bagian sesudahnya. Asam konjugasi di bagian sesudah mendapat ion hidrogen, sehingga di sisi sebelum senyawa yang kehilangan ion hidrogen adalah basanya. Sementara itu, basa konjugasi di sisi sesudah kehilangan ion hidrogen, sehingga senyawa yang mendapat hidrogen di sisi sebelum merupakan asamnya. Lihatlah reaksi asam-basa berikut:
Asam nitrat (HNO3) adalah "asam" karena asam nitrat menyerahkan proton kepada molekul air, sementara "basa konjugasi"nya adalah nitrat (NO−3). Molekul air menjadi basa karena mendapat proton hidrogen, sementara asam konjugasinya adalah ion hidronium (H3O+).
PenerapanSalah satu kegunaan asam dan basa konjugasi adalah dalam larutan dapar. Dalam larutan tersebut, asam lemah dan basa konjugasinya (dalam bentuk garam) atau basa lemah dengan asam konjugasinya digunakan untuk membatasi perubahan pH selama proses titrasi. Larutan dapar memiliki kegunaan organik dan anorganik; contohnya, darah manusia bertindak sebagai dapar untuk menjaga pH. Dapar yang paling penting di dalam aliran darah manusia adalah dapar asam karbonat-bikarbonat, yang mencegah perubahan pH secara drastis dari CO2. CO2 dapat meningkatkan pH akibat reaksi berikut: Kegunaan kedua dengan senyawa organik adalah produksi dapar dengan asam asetat. Jika asam asetat (asam lemah dengan rumus CH3COOH) dijadikan larutan dapar, asam ini perlu dicampur dengan basa konjugasinya, yaitu CH3COO− dalam bentuk garam. Hasilnya disebut dapar asetat yang mengandung CH3COOH berair dan CH3COONa berair. Asam asetat dan asam-asam lemah lainnya berfungsi sebagai komponen dapar yang berguna di laboratorium. Sementara itu, contoh kegunaan dengan senyawa anorganik adalah penggunaan medis basa konjugasi asam laktat dalam larutan laktat Ringer dan larutan Hartmann. Rumus asam laktat adalah C3H6O6, dan basa konjugasinya digunakan dalam cairan intravena yang mengandung natrium dan kalium beserta dengan laktat dan anion klorida dalam larutan dengan air yang terdistilasi. Cairan tersebut isotonik dengan darah manusia dan sering digunakan untuk meningkatkan kadar cairan di dalam suatu sistem setelah kehilangan darah akibat trauma, operasi atau luka bakar. Tabel asam dan basa konjugasinya
Tabel basa dan asam konjugasi
Referensi
|