|
Besi
Besi adalah unsur kimia dengan simbol Fe (dari bahasa Latin: ferrum) dan nomor atom 26. Besi merupakan logam dalam deret transisi pertama.[5] Besi adalah unsur paling umum di bumi berdasarkan massa, membentuk sebagian besar bagian inti luar dan dalam bumi. Besi adalah unsur keempat terbesar pada kerak bumi. Kelimpahannya dalam planet berbatu seperti bumi karena melimpahnya produksi akibat reaksi fusi dalam bintang bermassa besar, di mana produksi nikel-56 (yang meluruh menjadi isotop besi paling umum) adalah reaksi fusi nuklir terakhir yang bersifat eksotermal. Akibatnya, nikel radioaktif adalah unsur terakhir yang diproduksi sebelum keruntuhan hebat supernova. Keruntuhan tersebut menghamburkan prekursor radionuklida besi ke angkasa raya. Seperti unsur golongan 8 lainnya, besi berada pada rentang tingkat oksidasi yang lebar, −2 hingga +6, meskipun +2 dan +3 adalah yang paling banyak. Unsur besi terdapat dalam meteorit dan lingkungan rendah oksigen lainnya, tetapi reaktif dengan oksigen dan air. Permukaan besi segar tampak berkilau abu-abu keperakan, tetapi teroksidasi dalam udara normal menghasilkan besi oksida hidrat, yang dikenal sebagai karat. Tidak seperti logam lain yang membentuk lapisan oksida pasivasi, oksida besi menempati lebih banyak tempat daripada logamnya sendiri dan kemudian mengelupas, mengekspos permukaan segar untuk korosi. Logam besi telah digunakan sejak zaman purba, meskipun paduan tembaga, yang memiliki titik lebur lebih rendah, yang digunakan lebih awal dalam sejarah manusia. Besi murni relatif lembut, tetapi tidak bisa didapat melalui peleburan. Materi ini mengeras dan diperkuat secara signifikan oleh kotoran, karbon khususnya, dari proses peleburan. Dengan proporsi karbon tertentu (antara 0,002% dan 2,1%) menghasilkan baja, yang lebih keras dari besi murni, mungkin sampai 1000 kali. Logam besi mentah diproduksi di tanur tinggi, di mana bijih direduksi dengan batu bara menjadi pig iron, yang memiliki kandungan karbon tinggi. Pengolahan lebih lanjut dengan oksigen mengurangi kandungan karbon sehingga mencapai proporsi yang tepat untuk pembuatan baja. Baja dan paduan besi berkadar karbon rendah bersama dengan logam lain (baja paduan) sejauh ini merupakan logam yang paling umum digunakan oleh industri, karena lebarnya rentang sifat-sifat yang didapat dan kelimpahan batuan yang mengandung besi. Senyawa kimia besi memiliki banyak manfaat. Besi oksida dicampur dengan serbuk aluminium dapat dipantik untuk membuat reaksi termit, yang digunakan dalam pengelasan dan pemurnian bijih. Besi membentuk senyawa biner dengan halogen dan kalsogen. Senyawa organologamnya antara lain ferosen, senyawa sandwich pertama yang ditemukan. Besi memainkan peranan penting dalam biologi, membentuk kompleks dengan oksigen molekuler dalam hemoglobin dan myoglobin; kedua senyawa ini adalah protein pengangkut oksigen dalam vertebrata. Besi juga logam pada bagian aktif sebagian besar enzim redoks yang berperan dalam respirasi seluler serta oksidasi dan reduksi dalam tumbuhan dan hewan. KarakteristikSifat-sifat mekanis
Sifat mekanik besi dan paduannya dapat dievaluasi menggunakan berbagai uji, termasuk uji Brinell, uji Rockwell dan uji kekerasan Vickers. Data pada besi begitu konsisten sehingga sering digunakan untuk kalibrasi peralatan atau uji perbandingan.[7][8] Namun, sifat mekanik besi sangat dipengaruhi oleh kemurnian sampel: besi murni kristal tunggal untuk keperluan penenelitian faktanya lebih lunak daripada aluminium,[6] dan besi hasil produksi industri yang paling murni (99,99%) memiliki kekerasan 20–30 Brinell.[9] Kenaikan kandungan karbon dalam besi akan menyebabkan kenaikan yang signifikan pada kekerasan dan kekuatan tarik. Kekerasan maksimum 65 Rc dicapai dengan kadar karbon 0.6%, meskipun prosedur ini untuk logam dengan daya tarik rendah[10]  Karena signifikansinya untuk inti planet, sifat fisik besi pada tekanan dan suhu tinggi juga telah dipelajari secara mendalam. Bentuk besi yang stabil di bawah kondisi standar dapat mengalami tekanan hingga 15 GPa sebelum berubah menjadi bentuk tekanan tinggi, seperti yang dijelaskan pada bagian selanjutnya. Diagram fasa dan alotropBesi merupakan contoh alotropi pada logam. Setidaknya ada empat bentuk alotrop besi, yang dikenal sebagai α, γ, δ, dan ε; pada tekanan yang sangat tinggi dengan volume yang rendah, beberapa bukti eksperimental yang kontroversial ada untuk fase β yang stabil pada tekanan dan suhu yang sangat tinggi.[11]  Besi cair dingin mengkristal pada 1538 °C ke alotrop δ, yang memiliki struktur kristal body-centered cubic (bcc). Setelah mendingin lebih lanjut menjadi 1394 °C, berubah menjadi besi alotrop γ, dengan struktur kristal face-centered cubic (fcc), atau austenit. Pada 912 °C atau lebih rendah, struktur kristal berubah kembali menjadi alotrop besi α bcc, atau ferit. Akhirnya, pada 770 °C (titik Curie, Tc) besi menjadi magnet. Ketika besi melewati suhu Curie tidak ada perubahan dalam struktur kristal, tetapi ada perubahan dalam "struktur domain", di mana setiap domain mengandung atom besi dengan spin elektron tertentu. Dalam besi non magnet, semua spin elektron dari atom dalam satu domain berada dalam arah yang sama, namun, domain sekitarnya menunjuk ke berbagai arah lain sehingga dengan demikian secara keseluruhan mereka menetralkan satu sama lain. Hasilnya, besi tidak bersifat magnet. Dalam besi magnet, spin elektron dari semua domain selaras, sehingga efek magnetik domain tetangga saling memperkuat. Meskipun setiap domain mengandung miliaran atom, ukuran mereka sangat kecil, hanya sekitar 10 mikrometer.[12] Pada tekanan di atas sekitar 10 GPa dan suhu beberapa ratus kelvin atau kurang, besi-α berubah menjadi struktur hexagonal close-packed (hcp), yang juga dikenal sebagai besi-ε; fase-γ yang temperaturnya lebih tinggi juga berubah menjadi besi-ε, tetapi tidak terjadi pada tekanan yang lebih tinggi. Fase-β, jika ada, akan muncul pada tekanan minimal 50 GPa dan suhu minimal 1.500 K; telah diperkirakan memiliki struktur ortorombik atau struktur hcp ganda.[11] Besi sangat penting ketika dicampur dengan logam tertentu lainnya dan dengan karbon untuk membentuk baja. Ada banyak jenis baja, semua dengan sifat yang berbeda, dan pemahaman tentang sifat-sifat alotrop besi adalah kunci untuk pembuatan baja berkualitas baik. Besi-α, juga dikenal sebagai ferit, adalah bentuk besi paling stabil pada temperatur normal. Ini adalah logam yang cukup lunak yang dapat larut hanya dengan konsentrasi kecil karbon (tidak lebih dari 0,021% massa pada 910 °C).[13] Di atas 912 °C dan sampai 1400 °C besi-α mengalami transisi fasa dari bcc ke konfigurasi besi-γ fcc, juga disebut austenit. Logam Ini juga lunak tetapi dapat melarutkan jauh lebih banyak karbon (sebanyak 2,04% massa pada 1146 °C). Bentuk besi ini digunakan dalam jenis baja nirkarat yang digunakan untuk membuat peralatan makan, dan rumah sakit serta peralatan jasa layanan makanan.[12] Besi fasa tekanan tinggi penting sebagai model untuk bagian-bagian padat pada inti planet. Inti dalam planet bumi umumnya diasumsikan terdiri dari paduan besi-nikel dengan struktur ε (atau β). Titik lebur besi didefinisikan secara eksperimen dengan baik untuk tekanan sampai sekitar 50 GPa. Untuk tekanan yang lebih tinggi, studi yang berbeda menempatkan titik triple γ-ε cair pada tekanan yang berbeda hingga puluhan gigapascal dan menghasilkan perbedaan titik lebur lebih dari 1000 K. Secara umum, simulasi komputer dinamika molekuler pada besi yang sedang meleleh dan percobaan gelombang kejut memberikan titik leleh yang lebih tinggi dan kemiringan kurva lebur yang lebih curam daripada percobaan statis yang dilakukan dalam sel diamond anvil.[14] IsotopBesi alami terdiri dari empat isotop stabil: 5,845% 54Fe, 91,754% 56Fe, 2,119% 57Fe dan 0,282% 58Fe. Dari empat isotop stabil ini, hanya 57Fe yang mempunyai spin inti (−½). Nuklida 54Fe diperkirakan mengalami peluruhan beta ganda, tetapi proses ini belum pernah diteliti untuk nuklei ini, dan hanya batas bawah waktu paruh yang ditetapkan: t1/2>3,1×1022 tahun. 60Fe adalah radionuklida yang telah punah dengan waktu paruh panjang (2,6 juta tahun).[15] Ia tidak ditemukan di bumi, namun produk peluruhan utamanya adalah nuklida stabil nikel-60. Banyak riset masa lalu tentang pengukuran komposisi isotop Fe telah difokuskan pada penentuan variasi 60Fe karena proses yang menyertai nukleosintesis (yaitu, studi meteorit) dan formasi bijih. Namun dalam dekade terakhir, perkembangan teknologi spektrometri massa telah memungkinkan untuk melakukan deteksi dan kuantifikasi renik, variasi rasio alami isotop stabil besi. Banyak dari penelitian ini telah didorong oleh komunitas ilmu bumi dan planet, meskipun aplikasi untuk sistem biologis dan industri mulai bermunculan.[16] Isotop besi yang paling melimpah 56Fe merupakan daya tarik tersendiri bagi para ilmuwan nuklir karena merupakan titik akhir nukleosintesis yang paling umum.Hal ini sering dikutip, secara salah, sebagai isotop dengan energi ikatan tertinggi, perbedaan yang sebenarnya dimiliki nikel-62.[17] Karena 56Ni mudah dihasilkan dari inti yang lebih ringan dalam proses alfa pada reaksi nuklir di supernova (lihat proses pembakaran silikon), nikel-56 (14 partikel alfa) adalah titik akhir rantai fusi dalam bintang sangat besar, karena penambahan partikel alfa lain akan menghasilkan seng-60, yang membutuhkan lebih banyak energi. Oleh karena itu, nikel-56, dengan waktu paruh sekitar 6 hari, merupakan porsi terbesar dalam bintang-bintang ini, tetapi segera meluruh melalui emisi positron berturutan pada produk peluruhan supernova dalam awan gas sisa supernova. Peluruhan pertama membentuk kobalt-56, dan kemudian besi-56 yang stabil. Nuklida terakhir ini kemudian menjadi relatif mayoritas di jagat raya, dibandingkan dengan logam stabil lainnya dengan berat atom yang mendekati. Dalam fase meteorit Semarkona dan Chervony Kut korelasi antara konsentrasi 60Ni, produk anang 60Fe, dan kelimpahan isotop besi yang stabil dapat ditemukan yang merupakan bukti keberadaan 60Fe pada saat pembentukan Sistem Tata Surya. Kemungkinan energi yang dilepaskan pada peluruhan 60Fe, bersama energi yang dilepaskan pada peluruhan radionuklida 26Al, memberikan kontribusi pada pelelehan kembali dan diferensiasi asteroid setelah pembentukannya 4,6 miliar tahun yang lalu. Kelimpahan 60Ni dalam materi ekstraterestrial juga memberikan wawasan lebih jauh ke dalam asal mula Sistem Tata Surya dan sejarah awalnya.[18] Inti atom besi memiliki beberapa energi ikatan tertinggi per inti, hanya bisa diimbangi oleh isotop nikel 62Ni. Ini terbentuk melalui fusi nuklir pada bintang. Meskipun penambahan sedikit energi dapat diekstraksi melalui sintesis 62Ni, kondisi dalam bintang tidak cocok untuk proses ini. Distribusi unsur di Bumi lebih didominasi oleh besi daripada nikel, dan juga mungkin dalam produksi elemen supernova.[19] Besi-56 adalah isotop stabil terberat yang diproduksi melalui proses alfa dalam nukleosintesis stellar; unsur yang lebih berat daripada besi adalah nikel memerlukan supernova untuk pembentukannya. Besi adalah unsur yang paling melimpah dalam inti raksasa merah, dan logam paling melimpah dalam meteorit besi dan dalam inti planet yang berupa logam padat seperti bumi. NukleosintesisBesi dibentuk oleh bintang yang sangat besar dengan inti yang sangat panas (lebih dari 2,5 miliar kelvin) melalui proses pembakaran silikon. Ia merupakan unsur stabil terberat yang diproduksi dengan cara ini. Proses dimulai dari inti stabil kedua terbesar melalui pembakaran silikon, yaitu kalsium. Satu inti stabil kalsium mengalami fusi dengan satu inti helium, membentuk titanium yang tidak stabil. Sebelum titanium meluruh, ia dapat berfusi dengan inti helium lainnya, membentuk kromium yang tak stabil. Sebelum kromium meluruh, ia dapat berfusi dengan inti helium lainnya, membentuk besi yang tak stabil. Sebelum besi meluruh, ia dapat berfusi dengan inti helium lainnya, membentuk nikel-56 yang tak stabil. Fusi nikel-56 lebih jauh memerlukan energi dan bukannya menghasilkan energi, sehingga setelah produksi nikel-56, bintang tidak lagi menghasilkan energi yang dibutuhkan untuk menjaga inti agar tidak runtuh. Akhirnya, nikel-56 meluruh menjadi kobalt-56 yang tak stabil, yang pada gilirannya meluruh menjadi besi-56 yang stabil. Ketika inti bintang runtuh, ia membentuk supernova. Supernova juga menciptakan bentuk-bentuk besi stabil tambahan melalui proses-r. KeberadaanLihat pula Kategori: Mineral besi
Keberadaan di planet Besi adalah unsur paling melimpah keenam di jagat raya, dan merupakan unsur refraktori yang paling umum.[20] Ia terbentuk sebagai tahap eksotermal terakhir nukleosintesis stelar, melalui fusi silikon dalam bintang besar. Besi asli atau logam jarang ditemukan di permukaan bumi karena cenderung mengalami oksidasi, tetapi oksidanya menandakan dan mewakili bijih utamanya. Sementara kandungan besi pada kerak bumi hanya 5%, inti bumi bagian dalam dan luar diyakini memiliki kandungan paduan besi-nikel yang banyak, diperkirakan 35% dari keseluruhan massa bumi. Oleh karena itu, besi merupakan unsur paling melimpah di bumi, tetapi menduduki tempat keempat kelimpahan unsur di kerak bumi.[21][22] Sebagian besar besi pada kerak bumi ditemukan bersenyawa dengan oksigen sebagai mineral besi oksida seperti hematit (Fe) dan magnetit (Fe). Deposit besar besi ditemukan dalam banded iron formations. Formasi geologis ini adalah jenis batuan yang menandung lapisan-lapisan tipis besi oksida yang berulang (seperti pita-pita), dan diseling dengan lapisan serpih (bahasa Inggris: shale) dan rijang (bahasa Inggris: chert) yang miskin kandungan besinya. Banded iron formation terbentuk antara 3.700 juta tahun silam dan 1.800 juta tahun silam.[23][24] Sekitar 1 dalam 20 meteorit mengandung mineral unik besi-nikel taenit (35–80% iron) dan kamasit (90–95% iron). Meskipun jarang, meteorit besi adalah bentuk utama besi logam alami di permukaan bumi.[25] Warna merah permukaan Mars terbentuk dari regolit yang kaya besi oksida. Ini telah dibuktikan berdasarkan spektroskopi Mössbauer.[26] Cadangan yang digunakan di masyarakatMenurut Metal Stocks in Society report yang dikeluarkan oleh Panel Sumber Daya Internasional (bahasa Inggris: International Resource Panel), cadangan global besi yang digunakan di masyarakat adalah 2.200 kg (4.850 lb) per kapita. Sebagian besar adalah negara maju (7.000 kg (15.432 lb) – 14.000 kg (30.865 lb) per kapita) sedangkan negara yang kurang berkembang hanya 2.000 kg (4.409 lb) per kapita. Kimia dan senyawaLihat pula Kategori: Senyawa besi
Besi menunjukkan karakteristik sifat kimia logam transisi, misalnya kemampuan membentuk tingkat oksidasi yang bervariasi dan mampu membentuk ikatan koordinasi dan kimia organologam: memang penemuan senyawa besi, ferosen, yang memberi perubahan revolusioner pada bidang ini pada akhir 1950an.[27] Besi kadang-kadang dianggap sebagai prototipe untuk seluruh blok logam transisi, karena kelimpahannya dan perannya yang besar sekali dalam perkembangan teknologi kemanusiaan.[28] Keduapuluh enam elektronnya tertata dalam konfigurasi [Ar]3d64s2, yang elektron 3d dan 4s nya relatif memiliki energi yang berdekatan, sehingga dapat kehilangan elektron dalam jumlah yang bervariasi dan tidak ada titik yang jelas ionisasi lebih lanjut yang tidak menguntungkan.[29] Besi membentuk senyawa utamanya dalam tingkat oksidasi +2 dan +3. Menurut tradisi, senyawa besi(II) disebut fero dan senyawa besi(III) disebut feri. Besi juga dapat memiliki tingkat oksidasi yang lebih tinggi, contohnya adalah kalium ferat (K2FeO4), berwarna ungu, yang mengandung besi dengan bilangan oksidasi +6. Besi(IV) adalah bentuk antara yang umum dalam banyak reaksi oksidasi biokimia.[30][31] Sejumlah senyawa organologam mengandung tingkat oksidasi formal +1, 0, −1, atau bahkan −2. Tingkat oksidasi dan sifat ikatan lainnya sering diuji menggunakan teknik spektroskopi Mössbauer.[32] Terdapat juga banyak senyawa valensi campuran yang berintikan besi(II) dan besi(III) sekaligus, seperti magnetit dan biru Prusia (Fe4(Fe[CN]6)3).[31] Senyawa yang disebutkan terakhir di atas digunakan sebagai "biru" tradisional dalam cetak biru.[33]  Besi adalah logam transisi pertama yang tidak dapat mencapai keadaan oksidasi golongannya (+8), meskipun kongenernya yang lebih berat ruthenium dan osmium bisa, ruthenium lebih sulit daripada osmium.[34] Ruthenium menunjukkan kimia kation akuatik pada tingkat oksidasi rendahnya mirip dengan besi, tetapi osmium tidak, sehingga lebih stabil pada tingkat oksidasi tinggi dengan membentuk kompleks anion.[34] Kenyataannya, pada paruh kedua dari deret transisi 3d ini, kemiripan vertikal golongan dari atas ke bawah bersaing dengan kemiripan horizontal besi dengan tetangganya kobalt dan nikel pada tabel periodik, yang juga feromagnetik pada suhu ruang dan berbagi kemiripan kimia. Dengan demikian, besi, kobalt, dan nikel kadang-kadang dikelompokkan sebagai triad besi[28] Senyawa besi yang diproduksi dalam industri skala besar adalah besi(II) sulfat (FeSO4.7H2O) dan besi(III) klorida (FeCl3). Besi(II) sulfat adalah salah satu sumber besi(II) yang paling umum, tetapi kurang stabil terhadap oksidasi udara dibandingkan garam Mohr ((NH4)2Fe(SO4)2·6H2O). Senyawa besi(II) cenderung teroksidasi menjadi senyawa besi(III) di udara.[31] Tidak seperti logam lainnya, besi tidak membentuk amalgam dengan raksa. Sebagai hasilnya, raksa diperdagangkan dalam botol besi berukuran 76 lb (34 kg).[35] Sejauh ini besi adalah unsur yang paling reaktif dalam golongannya, bersifat piroforik ketika dihaluskan dan mudah larut dalam asam encer, membentuk Fe2+. Namun, besi tidak bereaksi dengan asam nitrat pekat dan asam oksidator, karena pembentukan lapisan oksida yang kuat yang dapat bereaksi dengan asam klorida.[34] Senyawa binerBesi bereaksi dengan oksigen di udara membentuk berbagai senyawa oksida dan hidroksida; yang paling umum adalah besi(II,III) oksida (Fe3O4), dan besi(III) oksida (Fe2O3). Besi(II) oksida juga ada, meskipun tidak stabil pada temperatur kamar. Oksida-oksida ini adalah bijih utama untuk produksi besi (lihat bloomery dan tanur tinggi). Mereka juga digunakan dalam produksi ferit, bermanfaat sebagai media penyimpanan magnetik di komputer, dan pigmen. Sulfida yang telah dikenal adalah besi pirit (FeS2), juga dikenal sebagai "emas bodoh" karena kilau keemasannya.[31]  Halida fero dan feri biner telah dikenal lama, dengan pengecualian feri iodida. Fero halida biasanya muncul dari pengolahan logam besi dengan asam halogen biner terkait untuk menghasilkan garam terhidrasi yang sesuai.[31] Besi bereaksi dengan fluor, klorin, dan bromin menghasilkan feri halida yang sesuai. Feri klorida adalah yang paling umum: Feri iodida adalah perkecualian, tidak stabil secara termodinamika karena sifat oksidator Fe3+ dan sifat reduktor I−:[36] Namun, feri iodida dalam jumlah miligram, padatan hitam, tetap dapat dibuat melalui reaksi besi pentakarbonil dengan iodium dan karbon monoksida dengan adanya heksana dan cahaya pada suhu −20 °C. Perlu dipastikan bahwa sistem tertutup rapat agar terhindar dari udara dan air.[36] Kimia larutan Potensial reduksi standar dalam larutan asam untuk beberapa ion besi yang umum adalah sebagai berikut:[34] Anion ferat(VI) yang berbentuk tetrahedral dan berwarna merah-ungu adalah oksidator kuat yang dapat mengoksidasi nitrogen dan amonia pada suhu kamar, dan bahkan air dalam larutan asam atau netral:[36] Ion Fe3+ memiliki kimia kationik sederhana yang besar, meskipun ion heksaquo [Fe(H2O)6]3+ yang berwarna ungu pucat sangat mudah terhidrolisis ketika pH dinaikkan di atas 0 sebagai berikut:[37]  Besi(III) oksida merah tua  Besi(II) sulfat heptahidrat biru-hijau Ketika pH naik di atas 0 terbentuk spesies hasil hidrolisis yang berwarna kuning, dan ketika dinaikkan di atas 2-3 terbentuk endapan besi(III) oksida hidrat yang berwarna coklat kemerahan. Meskipun Fe3+ memiliki konfigurasi d5, spektrum serapannya tidak seperti Mn2+ dengan pita d-d spin terlarangnya yang lemah, karena Fe3+ memiliki muatan positif yang lebih tinggi dan lebih terpolarisasi. Ini melemahkan energi serapan transfer muatan ligan-ke-logam. Oleh karena itu, semua kompleks di atas memililki warna yang agak kuat, dengan satu perkecualian ion heksaquo - dan bahkan yang memiliki spektrum yang didominasi oleh transfer muatan di daerah ultraviolet dekat.[37] Sebaliknya, ion besi(II) heksaquo [Fe(H2O)6]2+ yang berwarna hijau pucat tidak mengalami hidrolisis. Karbon dioksida tidak muncul ketika ditambahkan anion karbonat, malah menghasilkan endapan putih besi(II) karbonat. Dalam kondisi karbon dioksida berlebih, ini membentuk bikarbonat yang sedikit larut, yang jamak terjadi dalam air tanah, tetapi dengan cepat teroksidasi di udara membentuk besi(III) oksida yang menyebabkan endapan coklat di banyak aliran air.[38] Senyawa koordinasi dan organologamTelah dikenal beberapa kompleks sianida. Contoh yang paling terkenal adalah biru Prusia, (Fe4(Fe[CN]6)3). Kalium ferisianida dan kalium ferosianida juga telah diketahui; pembentukan biru Prusia pada reaksi dengan besi(II) dan besi(III) merupakan dasar "uji kimia basah".[31] Biru Prusia juga digunakan sebagai antidot pada keracunan talium dan sesium radioaktif.[39][40] Biru Prusia dapat digunakan untuk mencuci pakaian guna menghilangkan noda kekuningan yang ditinggalkan oleh garam besi dalam air. Telah dikenal beberapa senyawa karbonil besi. Senyawa besi(0) utama adalah besi pentakarbonil, Fe(CO)5, yang digunakan untuk memproduksi serbuk karbonil besi, bentuk yang sangat reaktif dari logam besi. Termolisis besi pentakarbonil menghasilkan gugus tiga-inti, triferum dodekakarbonil. Pereaksi Collman, dinatrium tetrakarbonilferat, adalah pereaksi yang digunakan dalam kimia organik. Pereaksi ini mengandung besi dengan tingkat oksidasi −2. Siklopentadienilferum dikarbonil dimer mengandung besi dengan tingkat oksidasi yang langka, yaitu +1.[41]  Ferosen (bahasa Inggris: Ferrocene) adalah kompleks yang sangat stabil. Senyawa sandwich pertama, yang mempunyai pusat besi(II) dengan dua ligan siklopentadienil yang terikat melalui kesepuluh atom karbonnya. Pengaturan ini adalah hal yang mengejutkan ketika pertama kali ditemukan,[42] tetapi penemuan ferosen memicu cabang baru kimia organologam. Ferosen sendiri dapat digunakan sebagai tulang punggung ligan, misalnya dppf. Ferosen dapat dioksidasi menjadi kation ferosenium (Fc+). Pasangan ferosen/ferosenium sering digunakan sebagai rujukan dalam elektrokimia.[43] SejarahBesi tempa  Besi telah digarap, atau ditempa, selama beberapa milenium. Namun, objek besi berumur panjang jauh lebih jarang daripada objek yang dibuat dari emas atau perak karena besi mudah berkarat . Manik-manik yang terbuat dari besi meteor di 3500 SM atau sebelumnya ditemukan di Gerzah, Mesir oleh G.A. Wainwright.[44] Manik-manik mengandung 7,5% nikel, yang merupakan tanda bahwa berasal dari meteor karena hanya sedikit besi yang ditemukan pada kerak bumi dan tidak ada kandungan nikelnya. Besi meteorit sangat dihormati karena asal-usulnya di langit dan sering digunakan untuk menempa senjata dan alat-alat atau seluruh spesimen yang ditempatkan di gereja-gereja.[45] Barang-barang yang terbuat dari besi oleh bangsa Mesir bertanggal 2500 hingga 3000 SM.[44] Besi memiliki keuntungan pembeda dibandingkan perunggu untuk peralatan perang. Besi jauh lebih keras dan lebih awet dibandingkan perunggu, meskipun rentan terhadap karat . Namun, hal. ini telah ditentang. Hittitolog Trevor Bryce berargumentasi bahwa sebelum teknik pengolahan besi tingkat lanjut dikembangkan di India, senjata besi meteorit yang digunakan oleh tentara Mesopotamia awal memiliki kecenderungan mudah hancur dalam peperangan, karena kandungan karbonnya yang tinggi.[46] Produksi besi pertama dimulai sejak Zaman Perunggu tengah tetapi memerlukan beberapa abad sebelum dapat menggantikan perunggu. Contoh leburan besi dari Asmar, Mesopotamia dan Tall Chagar Bazaar di Siria bagian utara dibuat antara 2.700 dan 3.000 SM.[47] Hittites tampaknya adalah yang pertama memahami produksi besi dari bijihnya dan sangat dihormati dalam masyarakat mereka. Mereka mulai melebur besi antara 1.500 dan 1.200 SM dan praktik ini tersebar ke Timur Dekat setelah kekaisaran mereka runtuk pada tahun 1.180 SM.[47] Periode berikutnya disebut Zaman Besi. Peleburan besi, oleh karenanya dinamakan Zaman Besi, mencapai Eropa dua ratus tahun kemudian dan tiba di Zimbabwe, Afrika pada abad ke-8.[47] Di China, besi hanya muncul sekitar tahun 700-500 SM.[48] Peleburan besi telah diperkenalkan kepada China melalui Asia Tengah.[49] Bukti awal penggunaan tanur tinggi di China berpenanggalan abad pertama setelah masehi,[50] dan tungku kubah (bahasa Inggris: cupola furnaces) digunakan pada awal periode perang (403–221 BCE).[51] Penggunaan tanur tinggi dan kubah tetap menyebar selama Dinasti Song dan Tang.[52] Artifak besi lebur ditemukan di India berpenanggalan antara 1.800 hingga 1.200 SM,[53] dan di Levant sejak sekitar 1.500 SM (menunjukkan peleburan di Anatolia atau Kaukasus).[54][55] Pengolahan besi masuk ke Yunani di akhir abad ke-11 SM.[56] Penyebaran pengolahan besi di Eropa Tengah dan Barat dihubungkan dengan ekspansi kaum Kelt. Menurut Gaius Plinius Secundus (Pliny the Elder) penggunaan besi adalah jamak pada era Romawi.[45] Produksi besi tahunan Kekaisaran Romawi diperkirakan 84.750 ton,[57] sementara China Han yang padat penduduk memproduksi sekitar 5.000 ton.[58] Selama Revolusi Industri di Inggris, Henry Cort mulai memperhalus besi dari besi kasar (bahasa Inggris: pig iron) dan besi tempa (atau besi batang) menggunakan sistem produksi inovatif. Pada tahun 1783, ia mematenkan proses puddling untuk mengolah bijih besi. Proses ini kemudian disempurnakan oleh peneliti lain, termasuk Joseph Hall. Besi tuang / besi corBesi tuang (atau besi cor) (bahasa Inggris: cast iron) pertama kali diproduksi di China selama abad ke-5 SM,[59] tetapi hampir tidak dikenal di Eropa sampai periode abad pertengahan.[60][61] Artifak besi tuang tertua ditemukan oleh arkeolog di tempat yang sekarang dikenal sebagai Luhe County, Jiangsu, China. Besi tuang digunakan oleh China kuno untuk peralatan perang, pertanian, dan arsitektur.[62] Selama periode abad pertengahan, di Eropa ditemukan sarana produksi besi tempa dari besi cor (dalam konteks ini dikenal sebagai besi kasar) dengan menggunakan finery forge. Pada seluruh proses ini, digunakan batu bara sebagai bahan bakar. Tanur tinggi abad pertengahan mempunyai tinggi sekitar 10 kaki (3,0 m) dan terbuat dari bata tahan api; udara tekan diperoleh dari penghembus yang digerakkan oleh tangan.[61] Tanur tinggi modern jauh lebih besar.  Pada tahun 1709, Abraham Darby I membentuk tanur tinggi batu bara untuk memproduksi besi tuang. Ketersediaan besi murah adalah salah satu faktor yang menyebabkan Revolusi Industri. Menjelang akhir abad ke-18, besi tuang mulai menggantikan besi tempa untuk tujuan tertentu, karena harganya yang lebih murah. Kandungan karbon dalam besi tidak dilihat sebagai alasan untuk membedakan sifat besi tempa, besi tuang, dan baja hingga abad ke-18.[47] Karena besi menjadi lebih murah dan lebih banyak, besi juga menjadi bahan struktural utama menyusul pembangunan inovatif jembatan besi pertama pada tahun 1778. Tabel kualitas komparatif besi tuangBesi tuang atau besi cor (bahasa Inggris: cast iron) adalah paduan besi-karbon dengan kandungan karbon lebih dari 2%.[63] Paduan besi dengan kandungan karbon kurang dari 2% disebut sebagai baja. Unsur paduan utama yang membentuk karakter besi tuang adalah karbon (C) antara 3-3,5% dan silikon (Si) antara 1,8-2,4%. Perbedaan kadar C dan Si menyebabkan titik lebur besi tuang lebih rendah dari baja, yakni sekitar 1.150 sampai 1.200 °C. Unsur paduan yang terkandung didalamnya mempengaruhi warna patahannya; besi tuang putih mengandung unsur karbida sedangkan besi tuang kelabu mengandung serpihan grafit.
BajaBaja (dengan kandungan karbon yang lebih kecil daripada besi kasar tetapi lebih banyak daripada besi tempa) pertama kali diproduksi menggunakan bloomery. Pandai besi di Luristan, Iran bagian barat membuat baja yang bagus pada 1.000 SM.[47] Kemudian, versi pengembagannya adalah, baja Wootz oleh India dan baja Damaskus dikembangkan sekitar 300 SM dan 500 setelah masehi. Metode ini adalah spesialisasi, dan oleh karenanya baja tiak menjadi komoditas utama hingga tahun 1850an.[65] Metode produksi baru adalah melalui karburasi besi batangan dalam proses sementasi ditemukan pada abad ke-17. Pada Revolusi Industri, metode baru memproduksi besi batangan tanpa batu bara ditemukan dan hal ini kemudian digunakan untuk memproduksi baja. Pada akhir 1850an, Henry Bessemer menciptakan proses pembuatan baja baru, melibatkan penghembusan udara melalui lelehan besi kasar untuk memproduksi baja lunak. Hal ini membuat baja jauh lebih ekonomis, oleh karena itu besi tempa tidak lagi diproduksi.[66] Baja tahan karatBaja tahan karat adalah istilah yang umum untuk semua jenis baja yang merupakan produk dari proses peleburan khusus, memiliki tingkat kemurnian yang tinggi, dan bereaksi merata terhadap panas yang diberikan. Berdasarkan definisi ini, baja stainless tidak harus selalu merupakan baja alloy atau baja alloy tinggi. Dalam uraian ini akan dibatasi pada baja stainless alloy tinggi dengan kandungan kromium setidaknya 10,5%. Berdasarkan strukturnya, baja stainless alloy tinggi dapat dikelompokkan ke dalam kategori berikut:
Baja tahan karat dengan kandungan kromium sebesar 10,5% hingga 13% dikategorikan sebagai lembam korosi karena kandungan kromiumnya yang rendah. Baja ini digunakan jika kriteria yang diutamakan adalah masa pakai, keamanan, dan tingkat perawatan yang rendah dan tidak ada kriteria spesifik yang dibutuhkan. Bidang aplikasi yang umum menggunakannya misalnya konstruksi kontainer, konstruksi gerbong, dan konstruksi kendaraan.
Baja tahan karat martensitik dengan kandungan kromium 12 hingga 18% dan kandungan karbon melebihi 0,1% akan berubah menjadi austenitik pada temperatur di atas 950 - 1050°C. Pendinginan cepat (quenching) akan menghasilkan struktur martensitik. Struktur ini, terutama jika dikeraskan dan didinginkan, akan menghasilkan kekuatan yang tinggi dan bahkan meningkatkan kandungan karbon. Baja tahan karat martensitik digunakan misalnya untuk produksi pisau silet, pisau, atau gunting.
Baja tahan karat austenitik (disebut juga: baja kromium-nikel) dengan kandungan nikel di atas 8% merupakan kombinasi yang ideal untuk aplikasi praktis yang terkait pemrosesan, ketahanan terhadap korosi, dan karakteristik mekanisnya. Karakteristik utama dari jenis baja stainless ini adalah ketahanan yang tinggi terhadap korosi. Atas dasar itu, baja stainless austenitik diterapkan di area dengan media yang agresif, misalnya kontak dengan air laut yang mengandung klorida dan dalam industri kimia dan makanan.
Baja tahan karat feritik-austenitik seringkali disebut juga baja dupleks karena merupakan komposit yang terbentuk dari dua struktur ini. Karena baja ini memiliki tingkat fleksibilitas yang tinggi dan juga memiliki ketahanan yang lebih baik terhadap korosi, baja jenis ini terutama cocok untuk penggunaan pada teknik lepas pantai. SAE steel gradesSistem nilai baja steel grades SAE adalah sistem penomoran paduan standar (SAE J1086 - Numbering Metals and Alloys) untuk nilai baja yang dikelola oleh SAE International.
Dasar kimia modernPada tahun 1774, Antoine Lavoisier mereaksikan uap air dengan besi logam di dalam tabung besi pijar untuk menghasilkan hidrogen dalam percobaan yang mengarah ke demonstrasi konservasi massa, yang mengubah instrumentasi kimia dari ilmu kualitatif menjadi kuantitatif. Oksidasi anaerobik besi pada temperatur tinggi secara skematis dapat ditunjukkan oleh reaksi berikut: Produksi besi logamJalur industriProduksi besi atau baja adalah suatu proses dengan dua tahapan utama, kecuali produk yang diinginkan adalah besi tuang. Tahap pertama adalah produksi besi kasar (pig iron) dalam tanur tinggi. Cara lain, reduksi langsung. Tahap kedua, besi kasar diubah menjadi besi tempa atau baja.   Untuk beberapa fungsi terbatas seperti inti elektromagnet, besi murni diproduksi dengan cara elektrolisis larutan fero sulfat. Bijih besi terdiri atas oksigen dan atom besi yang berikatan bersama dalam molekul. Besi sendiri biasanya didapatkan dalam bentuk magnetit (Fe3O4), hematit (Fe2O3), goethit, limonit atau siderit. Bijih besi biasanya kaya akan besi oksida dan beragam dalam hal warna, dari kelabu tua, kuning muda, ungu tua, hingga merah karat. Saat ini, cadangan biji besi tampak banyak, namun seiring dengan bertambahnya penggunaan besi secara eksponensial berkelanjutan, cadangan ini mulai berkurang, karena jumlahnya tetap. Sebagai contoh, Lester Brown dari Worldwatch Institute telah memperkirakan bahwa bijih besi bisa habis dalam waktu 64 tahun berdasarkan pada ekstrapolasi konservatif dari 2% pertumbuhan per tahun.[71][72]
Proses tanur tinggiProduksi besi industri dimulai dari bijih besi, biasanya hematit, dengan rumus Fe2O3, dan magnetit, dengan rumus Fe3O4. Bijih ini direduksi menjadi logam dalam suatu reaksi karbotermal, yaitu diberi perlakuan dengan karbon. Konversi ini biasa dilakukan dalam tanur tinggi pada temperatur sekitar 2000 °C. Karbon dipasok dalam bentuk kokas. Process ini juga mengandung fluks seperti limestone, yang digunakan untuk menghilangkan mineral silika dalam bijih, yang dapat menyimbat tanur. Kokas dan gamping dimasukkan melalui puncak tanur, ketika tengah terjadi ledakan hebat saat pemanasan udara, sekitar 4 ton per ton besi,[61] yang dipompa ke dalam tanur melalui bagian bawah. Di dalam tanur, kokas bereaksi dengan oksigen dalam ledakan udara menghasilkan karbon monoksida: Karbon monoksida yang mereduksi bijih besi (sesuai persamaan reaksi di bawah, hematite) menjadi lelehan besi, berubah menjadi karbon dioksida sesuai proses: Beberapa besi dalam temperatur tinggi di bagian-bagian tanur yang lebih dingin bereaksi langsung dengan kokas: Fluks yang berguna untuk melelehkan ketakmurnian dalam bijih biasanya adalah batu gamping (bahasa Inggris: limestone) (kalsium karbonat) dan dolomit (kalsium-magnesium karbonat). Fluks khusus lainnya digunakan bergantung pada karakteristik bijih. Panas di dalam tungku mengakibatkan fluks batu gamping terdekomposisi menjadi kalsium oksida (dikenal juga sebagai tawas): Kemudian kalsium oksida bereaksi dengan silikon dioksida membentuk slag. Slag meleleh karena panas tanur. Pada dasar tanur, lelehan slag mengapung di atas lelehan besi yang lebih padat, dan tingkap di bagian samping tanur dibuka untuk mengalirkan dan memisahkan besi dengan slag. Besi, ketika telah dingin, disebut besi kasar (pig iron), sementara slag dapat digunakan sebagai bahan konstruksi jalan atau bahan pengaya tanah yang miskin mineral untuk pertanian.[61]  Reduksi besi langsungKarena masalah lingkungan, telah dikembangkan metode alternatif pengolahan besi. "Reduksi besi langsung" mereduksi bijih besi menjadi serbuk yang dinamakan besi "karang" atau besi "langsung" yang cocok untuk pembuatan baja.[61] Dua reaksi utama pada proses reduksi langsung:
Silika dihilangkan dengan penambahan fluks gamping seperti telah dijelaskan di atas. Metode laboratorium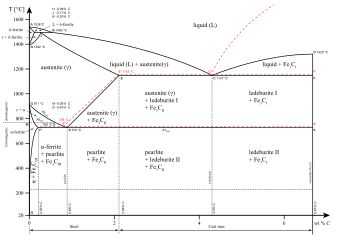 Besi logam secara umum diproduksi di laboratorium melalui dua metode. Pertama adalah elektrolisis fero klorida pada katode besi. Metode kedua melibatkan reduksi besi oksida dengan gas hidrogen pada temperatur sekitar 500 °C.[73] Aplikasi Metalurgi
Besi adalah logam yang paling banyak digunakan, mencakup 92% dari produksi logam dunia.[n 1] Biayanya yang rendah dan kekuatannya yang tinggi membuatnya sangat diperlukan dalam aplikasi teknik seperti pembangunan mesin dan peralatan mesin, mobil, lambung kapal-kapal besar, dan komponen struktur bangunan. Karena besi murni cukup lunak, hal ini paling sering dikombinasikan dengan unsur paduan untuk membuat baja. Besi yang tersedia untuk komersial diklasifikasikan berdasarkan kemurnian dan kandungan aditifnya. Pig iron memiliki 3,5-4,5% karbon[75] dan mengandung berbagai jumlah kontaminan seperti belerang, silikon dan fosfor. Pig iron bukan produk komersial, melainkan tahap antara dalam produksi besi tuang dan baja. Pengurangan kontaminan dalam pig iron yang berpengaruh negatif kepada sifat materi, seperti belerang dan fosfor, menghasilkan besi tuang yang mengandung 2–4% karbon, 1–6% silikon, dan sejumlah kecil mangan. Ia memiliki titik leleh di kisaran 1420-1470 K, lebih rendah daripada salah satu dari dua komponen utama, dan membuatnya produk pertama yang akan meleleh ketika karbon dan besi dipanaskan bersama-sama. Sifat mekaniknya sangat bervariasi dan bergantung pada bentuk karbon dalam paduan. Besi tuang "putih" mengandung karbon dalam bentuk sementit, atau besi-karbida. Senyawa keras dan rapuh ini mendominasi sifat mekanik besi tuang putih ini, sehingga tetap keras, tetapi tidak tahan kejut. Permukaan besi tuang putih yang rusak penuh goresan halus pecahan besi-karbida, suat bahan mengkilap, keperakan dan sangat pucat. Dalam besi abu-abu, karbon berbentuk serpihan halus grafit terpisah, dan juga membuat bahan rapuh karena serpihannya bermata tajam yang menghasilkan alokasi konsentrasi tegangan dalam materi. Varian baru dari besi abu-abu, disebut sebagai besi elastis yang diberi perlakuan khusus dengan magnesium dalam jumlah renik untuk mengubah bentuk grafit menjadi sferoid, atau nodul, mengurangi konsentrasi tegangan serta meningkatkan ketangguhan dan kekuatan material. Besi tempa mengandung kurang dari 0,25% karbon, tetapi mengandung terak dalam jumlah besar sehingga memberikan karakteristik berserat.[75] Ini adalah produk keras, dapat ditempa, tetapi tidak mudah dilebur seperti pig iron. Ia juga mudah diasah Besi tempa ditandai oleh adanya serat terak halus yang terperangkap dalam logam. Besi tempa lebih tahan korosi daripada baja. Produk blacksmithing dan "besi tempa" tradisional dan telah hampir sepenuhnya digantikan oleh baja ringan. Baja ringan lebih mudah berkarat daripada besi tempa, tetapi lebih murah dan lebih banyak tersedia. Baja karbon mengandung 2,0% karbon atau kurang,[76] ditambah sedikit mangan, belerang, fosfor, dan silikon. Baja paduan mengandung bervariasi jumlah karbon dan logam lain, seperti kromium, vanadium, molibdenum, nikel, wolfram, dan sebagainya. Kandungan paduannya mendongkrak biaya, sehingga biasanya hanya digunakan untuk keperluan khusus. Satu baja paduan umum, adalah baja nirkarat. Recent Perkembangan terkini dalam metalurgi besi telah menghasilkan berbagai baja paduan mikro, yang disebut juga baja 'HSLA' (singkatan dari bahasa Inggris: High Strength Low Alloy), mengandung sedikit tambahan untuk menghasilkan kekuatan tinggi dan biasanya ketangguhan spektakuler dengan biaya minimal. 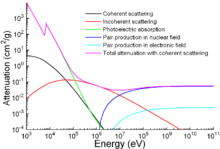 Terlepas dari aplikasi tradisional, besi juga digunakan untuk perlindungan dari radiasi pengion. Meskipun lebih ringan daripada bahan perlindungan tradisional lainnya, yaitu timbal, ini jauh lebih kuat secara mekanis. Atenuasi radiasi sebagai fungsi energi ditunjukkan dalam grafik. Kerugian utama besi dan baja adalah bahwa besi murni, dan sebagian besar paduannya, dapat membentuk karat jika tidak dilindungi. Pengecatan, galvanisasi, pasivasi, pelapisan plastik dan pembiruan semua digunakan untuk melindungi besi dari karat dengan menghalangi masuknya air dan oksigen atau dengan proteksi katodik. Senyawa besiMeskipun peran metalurgi dominan dalam hal jumlah, senyawa besi banyak digunakan oleh baik industri maupun kegunaan lainnya. Katalis besi secara tradisional digunakan dalam proses Haber-Bosch untuk produksi amonia dan proses Fischer-Tropsch untuk konversi karbon monoksida menjadi hidrokarbon untuk bahan bakar dan pelumas.[77] Serbuk besi dalam pelarut asam digunakan dalam reduksi Bechamp yaitu reduksi nitrobenzena menjadi anilin.[78] Besi(III) klorida digunakan untuk pemurnian air dan pengolahan limbah, untuk mewarnai tekstil, sebagai pewarna cat, sebagai aditif pakan ternak, dan sebagai etchant untuk tembaga dalam pabrikasi PCB.[79] Ini bisa juga dilarutkan dalam alkohol untuk membuat besi tincture. Halida lainnya cenderung memiliki penggunaan yang terbatas di laboratorium. Besi(II) sulfat digunakan sebagai prekursor untuk senyawa besi lainnya. Ini juga digunakan untuk mereduksi kromat dalam semen. Ini digunakan untuk memfortifikasi makanan dan mengobati anemia defisiensi besi. Hal di atas adalah kegunaan utamanya. Besi(III) sulfat digunakan dalam pengendapan partikel limbah dalam air tangki. Besi(II) klorida digunakan sebagai pereduksi flokulator, dalam pembentukan kompleks besi dan besi oksida magnetik, serta sebagai reduktor dalam sintesis organik. Korosi dan pencegahannyaKorosi besi memerlukan oksigen dan air. Berbagai jenis logam contohnya seng dan magnesium dapat melindungi besi dari korosi. Cara-cara pencegahan korosi besi yang akan dibahas berikut ini didasarkan pada dua sifat tersebut. Proses korosi besi disebut juga dengan perkaratan.
Peran biologiBesi melimpah dalam biologi.[80][81] Besi-protein ditemukan dalam semua organisme mulai dari yang promotif archaea hingga manusia. Warna darah disebabkan oleh hemoglobin, suatu protein yang mengandung besi. Seperti dalam hemoglobin, besi sering kali terikat pada kofaktor, misalnya dalam heme. Gugus besi-belerang adalah penyusun nitrogenase, suatu enzim yang bertanggung jawab pada fiksasi nitrogen biologis. Pengaruh teori evolusi memberikan peran pada besi sulfida dalam teori besi-belerang dunia.  Besi adalah unsur renik penting yang ditemukan di hampir semua organisme hidup. Enzim dan protein mengandung besi, sering kali mengandung gugus prostetik heme, yang berperan besar dalam oksidasi dan transportasi biologis. Contoh protein yang ditemukan dalam organisme tingkat tinggi antara lain hemoglobin, sitokrom (lihat besi valensi tinggi), dan katalase.[82] Senyawa bioanorganikSenyawa besi "bioanorganik" (yaitu senyawa besi yang digunakan dalam biologi) yang paling banyak diketahui adalah protein heme: contohnya: hemoglobin, myoglobin, dan sitokrom P450. Senyawa-senyawa ini dapat melakukan transportasi gas, membuat enzim, dan digunakan dalam transfer elektron. Metaloprotein adalah gugus protein dengan ion logam kofaktor. Beberapa contoh besi metaloprotein adalah feritin dan rubredoksin. Banyak enzim vital untuk kehidupan mengandung besi, seperti katalase, lipoksigenase, dan IRE-BP. Kesehatan dan dietBesi memang melimpah, tetapi sumber zat besi utama antara lain daging merah, kacang-kacangan, kacang, daging unggas, ikan, sayuran hijau, selada air, tahu, buncis, kacang polong, roti yang difortifikasi, dan sereal yang difortifikasi. Besi dalam jumlah kecil ditemukan dalam molases, tef, dan tepung kentang (farina). Besi dalam daging (besi heme) lebih mudah diserap daripada besi dalam sayuran.[83] Meskipun sejumlah studi menyebutkan bahwa heme/hemoglobin dari daging merah mempunyai efek yang dapat meningkatkan kemungkinan kanker usus besar,[84][85] tetapi tetap ada sejumlah kontroversi,[86] dan bahkan ada beberapa studi yang menyatakan bahwa tidak ada bukti cukup yang mendukung klaim semacam itu.[87] Besi yang ada dalam suplemen makanan sering kali ditemukan sebagai besi(II) fumarat, meskipun besi sulfat lebih murah dan dapat diserap cukup baik. Unsur besi, meski efisiensi penyerapannya hanya ⅓ relatif dari besi sulfat,[88] sering ditambahkan dalam makanan seperti sereal dan tepung terigu. Besi yang paling mudah diserap tubuh apabila di-khelat-kan dengan asam amino[89] dan juga tersedia sebagai suplemen besi. Seringkali asam amino yang dipilih adalah yang termurah dan paling umum yaitu glisin, dalam bentuk suplemen "besi glisinat".[90] Angka Kecukupan Gizi (AKG) yang dianjurkan (bahasa Inggris: Recommended Dietary Allowance (RDA)) untuk besi beragam sesuai umur, jenis kelamin, dan sumber zat besi (besi berbasis heme memiliki bioavilabilitas yang lebih tinggi).[91] Bayi memerlukan suplemen besi jika mengkonsumsi susu formula.[92] Pendonor darah dan wanita hamil berisiko mengalami kekurangan besi dan sering kali dianjurkan untuk mengkonsumsi suplemen besi.[93] Penyerapan dan penyimpananAkuisisi besi menghadapi masalah bagi organisme aerobik, karena ion feri sukar larut pada pH mendekati netral. Oleh karena itu, bakteri telah melibatkan senyawa sekuestor yang disebut siderofora (bahasa Inggris: siderophore).[94][95][96] Setelah diserap, dalam sel, penyimpanan besi diatur dengan hati-hati; ion besi "bebas" tidak tersedia begitu saja. Komponen utama yang mengatur ini adalah protein transferin, yang mengikat ion besi yang diserap dari duodenum dan mengangkutnya melalui aliran arah menuju sel.[97] Pada hewan, tumbuhan, dan jamur, besi sering kali berupa ion yang berbentuk kompleks heme. Heme adalah komponen esensial protein sitokrom, yang mengatur reaksi redoks, dan komponen esensial protein pengangkut oksigen seperti hemoglobin, myoglobin, dan leghemoglobin. Besi anorganik berkontribusi pada reaksi redoks dalam gugus besi-belerang enzim, seperti nitrogenase (terlibat dalam sintesis amonia dari nitrogen dan hidrogen) serta hidrogenase. Protein besi non-heme meliputi enzim metana monooksigenase (mengoksidasi metana menjadi metanol), ribonukleotida reduktase (mereduksi ribosa menjadi deoksiribosa; biosintesis DNA), hemertrin (transpor oksigen dan fiksasi dalam invertebrata laut) serta asam fosfatase ungu (hidrolisis ester fosfat). Distribusi besi sangat diatur dalam mamalia, terutama karena ion besi berpotensi tinggi pada toksisitas biologis.[98] Pengaturan asupanAsupan besi diatur ketat oleh tubuh manusia, yang tidak memiliki pengaturan fisiologis ekskresi besi. Hanya sejumlah kecil besi yang hilang setiap hari karena peluruhan sel mukosa dan epitel kulit, sehingga pengendalian level besi sangat diatur dari asupannya.[99] Pengaturan asupan besi tidak berlangsung sempurna pada beberapa orang akibat dari cacat genetik yang memetakan region gen HLA-H pada kromosom 6. Pada orang-orang ini, kelebihan asupan dapat mengakibatkan kelainan akibat kelebihan besi (bahasa Inggris: iron overload disorder), seperti hemokromatosis. Banyak orang memiliki kerentanan genetik terhadap kelebihan zat besi tanpa menyadarinya atau menyadari masalah sejarah keluarga. Berdasarkan alasan tersebut, disarankan untuk tidak mengkonsumsi suplemen besi kecuali mengalami defisiensi besi dan telah berkonsultasi dengan dokter. Hemokromatosis diperkirakan menyebabkan penyakit antara 0,3 dan 0,8% di kalangan ras kaukasia.[100] MRI menemukan bahwa besi terakumulasi dalam hipokampus otak pada penderita Alzheimer dan dalam substansia nigra pada penderita Parkinson.[101] BioremediasiBakteri pemakan besi hidup di lambung kapal karam seperti Titanic.[102] Bakteti asidofil Acidithiobacillus ferrooxidans, Leptospirillum ferrooxidans, Sulfolobus spp., Acidianus brierleyi and Sulfobacillus thermosulfidooxidans dapat mengoksidasi enzimatis besi fero.[103] Sample jamur Aspergillus niger ditemukan tumbuh dari larutan penambangan emas, dan ditemukan mengandung kompleks sianologam seperti emas, perak, tembaga, besi dan seng. Jamur juga berperan dalam kemudahlarutan sulfida logam berat.[104] Hambatan permeabel reaktifBesi zerovalen adalah materi reaktif utama pada hambatan permeabel reaktif.[105] ToksisitasMencerna besi dalam jumlah besar dapat menyebabkan kelebihan kadar besi dalam darah. Kadar besi fero yang tinggi dalam darah bereaksi dengan peroksida membentuk radikal bebas, yang sangat reaktif dan dapat merusak DNA, protein, lemak, dan komponen sel lainnya. Oleh karena itu, toksisitas besi muncul ketika besi bebas dalam sel, yang biasanya terjadi ketika kadar besi melebihi kemampuan transferin mengikat besi. Kerusakan pada sel saluran pencernaan dapat juga menghambat pengaturan asupan besi yang berakibat pada peningkatan lebih lanjut kadar besi darah. Besi umumnya merusak sel dalam jantung, liver dan lainnya, yang dapat menyebabkan efek parah, termasuk koma, asidosis metabolik, syok, kegagalan liver, koagulopati, sindrom distres pernapasan dewasa (bahasa Inggris: adult respiratory distress syndrome), kerusakan organ jangka panjang, dan bahkan kematian.[106] Manusia mengalami keracunan besi di atas 20 miligram besi per kilogram berat badan, dan 60 miligram per kilogram adalah dosis letal.[107] Asupan besi berlebihan, sering kali akibat dari konsumsi berlebih tablet fero sulfat pada anak-anak tetapi dengan dosis dewasa. Ini adalah salah satu keracunan umum yang menyebabkan kematian pada anak-anak usia di bawah enam tahun.[107] Standar Asupan Gizi (bahasa Inggris: Dietary Reference Intake (DRI)) mencantumkan Batas Atas Toleransi (bahasa Inggris: Tolerable Upper Intake Level (UL)) untuk dewasa adalah 45 mg/hari. Untuk anak-anak di bawah empat belas tahun, UL-nya 40 mg/hari. Pengelolaan medis keracunan besi adalah rumit, dan dapat berupa penggunaan zat pengkhelat yang disebut deferoksamina untuk mengikat dan mengeluarkan kelebihan besi dari dalam tubuh.[106][108][109] Lihat pula
Referensi
Catatan kaki
Daftar pustaka
Bacaan lanjutan
Lihat entri iron di kamus bebas Wiktionary. Wikimedia Commons memiliki media mengenai Iron. Pranala luar
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
















![{\displaystyle {\ce {[Fe(H2O)6]^3+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/19c655a056f19828f2467119901464d134440231)
![{\displaystyle {\ce {<=> [Fe(H2O)5(OH)]^2+ + H^+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2b100fca915eb6a0f04728b5c372dbf0748e028c)


![{\displaystyle {\ce {[Fe(H2O)5(OH)]^2+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c52d74e1194aef9edd81c7e23d7f746490a7c753)
![{\displaystyle {\ce {<=> [Fe(H2O)4(OH)2]^+ + H^+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e7b2a163231a263fec7fcd8caa3c21177c6c27ea)

![{\displaystyle {\ce {2[Fe(H2O)6]^3+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9097ac29f61fdb9c4584a5271fcae61ebd296ac7)
![{\displaystyle {\ce {<=> [Fe(H2O)4(OH)]2^4+ + 2H^+ + 2H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bca55f44f6cc1f237dd426781fadd5402a54ef5e)












