|
Aktinium
Aktinium adalah sebuah unsur kimia radioaktif dengan lambang Ac dan nomor atom 89. Ia adalah unsur kimia radioaktif yang ditemukan tahun 1899. Ia adalah unsur radioaktif non-primordial pertama yang diisolasi: polonium, radium dan radon diamati sebelum aktinium, namun baru diisolasi tahun 1902. Aktinium memberi nama pada deret aktinida, golongan yang berisi 15 unsur serupa antara aktinium dan lawrencium pada tabel periodik. Ini juga kadang-kadang dianggap sebagai logam transisi periode ke-7 yang pertama, walaupun lawrencium kurang umum berada pada posisi itu. Sebagai logam radioaktif lunak, berwarna putih keperakan, aktinium bereaksi cepat dengan oksigen dan uap air di udara membentuk lapisan putih aktinium oksida yang mencegah oksidasi lebih lanjut. Seperti kebanyakan lantanida dan aktinida, aktinium memiliki tingkat oksidasi +3 di hampir semua senyawa kimianya. Aktinium hanya ditemukan dalam jumlah renik di bijih uranium dan thorium sebagai isotop 227Ac, yang meluruh dengan waktu paruh 21,772 tahun, dengan didominasi emisi partikel beta dan kadang-kadang alfa, dan 228Ac, yang beta aktif dengan waktu paruh 6,15 jam. Satu ton uranium alami dalam bijihnya mengandung sekitar 0,2 miligram aktinium-227, dan satu ton torium alami mengandung sekitar 5 nanogram aktinium-228. Kemiripan sifat fisika dan kimia aktinium dan lantanum membuat pemisahan aktinium dari bijihnya menjadi tidak praktis. Sebagai gantinya, unsur ini disiapkan, dalam jumlah miligram, dengan iradiasi neutron 226Ra dalam sebuah reaktor nuklir. Karena kelangkaannya, harganya yang tinggi dan radioaktivitasnya, aktinium tidak memiliki kegunaan industri yang signifikan. Aplikasinya saat ini termasuk sumber neutron dan zat untuk radioterapi yang menyasar sel kanker di dalam tubuh. SejarahAndré-Louis Debierne, seorang kimiawan Prancis, mengumumkan penemuan unsur baru pada tahun 1899. Dia memisahkannya dari residu pitchblende yang ditinggalkan oleh Marie dan Pierre Curie setelah mereka mengekstraksi radium. Pada sekitaran tahun 1899, Debierne menggambarkan zat itu serupa dengan titanium[4] dan (pada tahun 1900) sebagai mirip dengan torium.[5] Friedrich Oskar Giesel secara terpisah menemukan aktinium pada tahun 1902[6] sebagai zat yang mirip dengan lantanum dan menyebutnya "emanium" pada tahun 1904.[7] Setelah membandingkan waktu paruh zat yang ditentukan oleh Debierne,[8] Harriet Brooks pada tahun 1904, dan Otto Hahn serta Otto Sackur pada tahun 1905, pilihan nama Debierne untuk unsur baru ini dipertahankan karena pertimbangan senioritas, meskipun terdapat pertentangan sifat kimia yang ia klaim untuk unsur ini pada waktu yang berbeda.[9][10] Artikel yang diterbitkan pada tahun 1970an[11] dan kemudian[12] menunjukkan bahwa hasil Debierne yang diterbitkan pada 1904 bertentangan dengan yang dilaporkan pada tahun 1899 dan 1900. Selanjutnya, kimia aktinium yang diketahui sekarang ini menghalangi kehadirannya sebagai sesuatu selain konstituen minor dari hasil Debierne pada tahun 1899 dan 1900. Sebenarnya, sifat kimia yang dia laporkan membuat kemungkinan dia telah, secara tidak sengaja mengidentifikasi protaktinium, yang tidak akan ditemukan selama empat belas tahun lagi, hanya untuk membuatnya menghilang karena hidrolisis dan adsorpsi pada peralatan laboratoriumnya. Hal ini menyebabkan beberapa penulis menganjurkan agar Giesel sendiri yang harus diberi kredit dengan penemuan tersebut.[11] Visi penemuan ilmiah yang lebih adem diajukan oleh Adloff.[12] Dia menyarankan agar kritik terhadap publikasi awal harus dimaklumi dengan keadaan radiokimia yang baru lahir: dengan menyoroti kehati-hatian klaim Debierne di surat kabar awal, dia mencatat bahwa tidak ada yang dapat berpendapat bahwa zat Debierne tidak mengandung aktinium.[12] Debierne, yang sekarang dianggap oleh sebagian besar sejarawan sebagai penemunya, kehilangan minat pada unsur tersebut dan meninggalkan topik tersebut. Giesel, di sisi lain, akan dapat dikreditkan dengan pertama diberi kredit dengan preparasi pertamanya atas aktinium murni secara radiokimia dan dengan identifikasi dari nomor atomnya 89.[11] Nama actinium berasal dari bahasa Yunani kuno aktis, aktinos (ακτίς, ακτίνος), yang berarti cahaya atau sinar.[13] Simbolnya, Ac, juga digunakan dalam singkatan senyawa lain yang tidak ada hubungannya dengan aktinium, seperti asetil, asetat[14] dan terkadang asetaldehida.[15] Sifat-sifatActinium adalah unsur logam radioaktif yang lunak, berwarna putih keperakan.[16][17] Diperkirakan modulus gesernya serupa dengan timbal.[18] Karena radioaktivitasnya yang kuat, aktinium bercahaya dalam gelap dengan cahaya biru pucat, yang berasal dari udara sekitarnya yang terionisasi oleh partikel energik yang dipancarkan.[19] Aktinium memiliki sifat kimia yang serupa dengan lantanum dan lantanida lainnya, dan oleh karena itu unsur-unsur ini sulit dipisahkan saat mengekstraksinya dari bijih uranium. Ekstraksi pelarut dan kromatografi ion adalah metode pemisahan yang biasa digunakan.[20] Unsur pertama dari aktinida, aktinium digunakan untuk nama golongannya, seperti lantanum untuk lantanida. Golongan unsur ini lebih beragam daripada lantanida dan oleh karena itu pada tahun 1928 Charles Janet mengusulkan perubahan yang paling signifikan pada tabel periodik Dmitri Mendeleev sejak pengakuan lantanida, dengan memperkenalkan aktinida, sebuah gerakan yang disarankan ulang pada tahun 1945 oleh Glenn T. Seaborg.[21] Aktinium bereaksi cepat dengan oksigen dan uap air di udara membentuk lapisan putih aktinium oksida yang menghambat oksidasi lebih lanjut.[16] Seperti kebanyakan lantanida dan aktinida, aktinium berada pada keadaan oksidasi +3, dan ion Ac3+ tidak berwarna dalam larutan.[22] Keadaan oksidasi +3 berasal dari konfigurasi elektron aktinium [Rn]6d17s2, dengan tiga elektron valensi yang mudah dilepaskan untuk memberikan struktur kelopak tertutup gas mulia radon yang stabil.[17] Keadaan oksidasi +2 yang langka hanya dikenal untuk aktinium dihidrida (AcH2); bahkan ini sebenarnya adalah senyawa elektrida seperti kongenernya yang lebih ringan LaH2.[23] Senyawa kimiaHanya sedikit senyawa aktinium yang diketahui termasuk AcF3, AcCl3, AcBr3, AcOF, AcOCl, AcOBr, Ac2S3, Ac2O3 dan AcPO4. Kecuali AcPO4, semuanya serupa dengan senyawa lantanum yang sesuai. Mereka semua mengandung aktinium dalam tingkat oksidasi +3.[22][24] Secara khusus, konstanta kisi dari analog senyawa lantanum dan aktinium berbeda hanya beberapa persen.[25]
Di sini a, b dan c adalah konstanta kisi, No adalah nomor kelompok ruang dan Z adalah jumlah unit rumus per unit sel. Densitas tidak diukur secara langsung namun dihitung dari parameter kisi. OksidaAktinium oksida (Ac) dapat diperoleh dengan memanaskan hidroksidanya pada 500 °C atau oksalatnya pada 1100 °C, dalam vakum. Kisi kristalnya isotipik dengan oksida-oksida dari sebagian besar logam tanah jarang trivalen.[25] HalidaAktinium trifluorida dapat diproduksi baik dalam reaksi larutan maupun dalam reaksi padat. Metode pertama dilakukan pada suhu kamar, dengan menambahkan asam fluorida ke dalam larutan yang mengandung ion aktinium. Dalam metode reaksi padat, logam aktinium diperlakukan dengan uap hidrogen fluoride pada 700 °C dengan menggunakan peralatan yang terbuat dari platina. Memperlakukan aktinium trifluorida dengan amonium hidroksida pada 900-1000 °C menghasilkan oksifluorida AcOF. Sementara lantanum oksifluorida dapat dengan mudah diperoleh dengan membakar lantanum trifluorida di udara pada suhu 800 °C selama satu jam, perlakuan serupa terhadap aktinium trifluorida tidak menghasilkan AcOF dan hanya menghasilkan lelehan produk awal.[25][30] Aktinium triklorida diperoleh dengan mereaksikan hidroksida atau oksalat dengan uap karbon tetraklorida pada suhu di atas 960 °C. Sama seperti oksifluorida, aktinium oksiklorida dapat dibuat dengan hidrolisis aktinium triklorida dengan amonium hidroksida pada suhu 1000 °C. Namun, sebaliknya dengan oksifluorida, oksiklorida dapat disintesis dengan baik dengan menyalakan larutan aktinium triklorida dalam asam klorida dengan amonia.[25] Reaksi aluminium bromida dan aktinium oksida menghasilkan aktinium tribromida, AcBr3: dan ketika AcBr3 diberi perlakuan dengan amonium hidroksida pada 500 °C menghasilkan oksibromida AcOBr.[25] Senyawa lainAktinium hidrida diperoleh melalui reduksi aktinium triklorida dengan kalium pada 300 °C, dan strukturnya disimpulkan analog dengan hidrida LaH2 yang sesuai. Sumber hidrogen dalam reaksi ini tidak jelas.[31] Mencampur mononatrium fosfat (NaH2PO4) dengan larutan aktinium dalam asam klorida menghasilkan aktinium fosfat hemihidrat (AcPO4·0,5H2O) yang berwarna putih, dan memanaskan aktinium oksalat dengan uap hidrogen sulfida pada 1400 °C selama beberapa menit menghasilkan aktinium sulfida (Ac2S3) yang berwarna hitam. Itu mungkin dihasilkan melalui aksi campuran hidrogen sulfida dan karbon disulfida terhadap aktinium oksida pada suhu 1000 °C[25] IsotopAktinium yang terjadi secara alami tersusun dari dua isotop radioaktif; 227Ac (dari keluarga radioaktif 235U) dan 228Ac (cucu dari 232Th). 227Ac meluruh terutama sebagai pemancar beta dengan energi yang sangat kecil, tetapi sebanyak 1,38% dari kejadian peluruhan, ia memancarkan partikel alfa, sehingga dapat mudah diidentifikasi melalui spektrometri alfa.[11] Sebanyak tiga puluh enam radioisotop telah diidentifikasi, yang paling stabil adalah 227Ac dengan waktu paruh 21,772 tahun, 225Ac dengan waktu paruh 10 hari dan 226Ac dengan waktu paruh 29,37 jam. Seluruh isotop radioaktif yang tersisa memiliki waktu paruh kurang dari 10 jam dan mayoritas dari mereka memiliki waktu paruh kurang dari satu menit. Isotop aktinium dengan umur terpendek adalah 217Ac (waktu paruh 69 nanodetik) yang meluruh melalui peluruhan alfa dan tangkapan elektron. Aktinium juga memiliki dua keadaan meta (meta state) yang diketahui.[32] Isotop yang paling signifikan untuk kimia adalah 225Ac, 227Ac, dan 228Ac[11] 227Ac yang dimurnikan berada dalam kesetimbangan dengan produk peluruhannya setelah sekitar setengah tahun. Ia meluruh sesuai waktu paruhnya (21,772 tahun) dengan memancarkan mayoritas partikel beta (98,62%) dan beberapa partikel alfa (1,38%);[32] produk peluruhan yang berturutan adalah bagian dari deret aktinium. Mengingat jumlah yang tersedia rendah, energi partikel beta-nya juga rendah (maksimum 44,8 keV), dan intensitas radiasi alfanya juga rendah, 227Ac sulit dideteksi langsung melalui emisinya dan oleh karena itu ditelusuri melalui produk peluruhannya.[22] Isotop aktinium memiliki kisaran berat atom dari 206 u (206Ac) sampai 236 u (236Ac).[32]
Keterjadian dan sintesis Aktinium dijumpai hanya dalam jumlah renik dalam bijih uranium – satu ton uranium dalam bijih mengandung sekitar 0,2 miligram 227Ac[33][34] – dan dalam bijih torium, mengandung 5 nanogram 228Ac per ton torium. Isotop aktinium 227Ac adalah anggota sementara rantai peluruhan seri uranium-aktinium, yang dimulai dengan isotop induk 235U (atau 239Pu) dan diakhiri dengan isotop timbal yang stabil 207Pb. Isotop aktinium lainnya (225Ac) hadir sejenak dalam rantai peluruhan seri neptunium, yang dimulai dari 237Np (atau 233U) dan diakhiri dengan 205Tl dan 209Bi yang agak stabil, tetapi rantai ini hanya terdapat di masa awal tata surya, karena waktu paruh neptunium-237 yang pendek. Konsentrasi alaminya yang rendah, serta kemiripan sifat fisika dan kimianya dengan lantanum dan lantanida lainnya, yang selalu melimpah dalam bantalan bijih aktinium, membuat pemisahan aktinium dari bijihnya menjadi tidak praktis, dan pemisahan lengkap tidak pernah tercapai.[25] Sebagai gantinya, aktinium dibuat, dalam skala miligram, dengan iradiasi netron terhadap 226Ra dalam reaktor nuklir.[34][35] Reaksi ini menghasilkan sekitar 2% dari berat radium. 227Ac lebih lanjut dapat menangkap neutron menghasilkan sekelumit 228Ac. Setelah disintesis, aktinium dipisahkan dari radium serta dari produk peluruhan dan fusi nuklir, seperti torium, polonium, timbal, dan bismut. Ekstraksi dapat dilakukan dengan larutan teoniltrifluoroaseton-benzena dari larutan akuatik produk radiasi, dan selektivitasnya terhadap unsur tertentu dapat dicapai melalui pengaturan pH (pada kisaran 6,0 untuk aktinium).[33] Prosedur alternatif adalah pertukaran anion menggunakan resin yang sesuai dalam asam nitrat, yang dapat menghasilkan faktor pemisahan sekitar 1.000.000 untuk radium dan aktinium vs. torium dalam proses dua tahap. Aktinium kemudian dapat dipisahkan dari radium, dengan rasio sekitar 100, menggunakan resin pertukaran kation pertautan silang dengan eluan asam nitrat.[36] 225Ac pertama kali diproduksi secara artifisial di Institute for Transuranium Elements (ITU) di Jerman menggunakan siklotron dan di St George Hospital di Sydney menggunakan akselerator partikel linier (LINAC) pada tahun 2000.[37] Isotop langka ini memiliki aplikasi potensial dalam terapi radiasi dan paling efisien diproduksi dengan membombardir target radium-226 dengan ion deuterium 20-30 MeV. Reaksi ini juga menghasilkan 226Ac yang bagaimanapun meluruh dengan waktu paruh 29 jam dan dengan demikian tidak mencemari 225Ac.[38] Logam aktinium telah dibuat melalui reduksi aktinium fluorida dengan uap litium dalam kondisi vakum pada suhu antara 1100 dan 1300 °C. Temperatur yang lebih tinggi menghasilkan penguapan produk dan suhu lebih rendah menyebabkan transformasi menjadi tidak sempurna. Litium dipilih di antara logam alkali lainnya karena fluoridanya paling mudah menguap.[13][16] AplikasiMengingat kelangkaannya, harganya yang tinggi serta radioaktivitasnya, saat ini aktinium tidak memiliki kegunaan industrial yang signifikan.[13] 227 sangat radioaktif dan oleh karenanya dipelajari penggunaannya sebagai unsur aktif untuk generator termoelektrik radioisotop, misalnya dalam pesawat ruang angkasa. Oksida 227 yang dipress dengan berilium juga merupakan suatu sumber neutron yang efisien dengan aktivitas melebihi standar pasangan americium-berilium dan radium-berilium.[39] Dalam seluruh aplikasi tersebut, 227 (sumber beta) hanyalah biang yang menghasilkan isotop pemancar alfa pada peluruhannya. Berilium menangkap partikel alfa dan memancarkan neutron karena penampangnya yang besar untuk reaksi nuklir (α,n): Sumber neutron 227 dapat diaplikasikan dalam probe neutron – sebuah perangkat standar untuk mengukur kuantitas air yang terdapat dalam tanah, dan juga penentuan kelembaban/densitas untuk pengendalian mutu dalam konstruksi jalan raya.[40][41] Such probes are also used in well logging applications, in neutron radiography, tomography and other radiochemical investigations.[42] 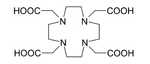 225 diterapkan dalam pengobatan untuk menghasilkan 213 dalam generator yang dapat dipakai ulang[36] atau dapat digunakan tersendiri sebagai zat untuk terapi radiasi, terutama dalam penargetan terapi alfa target (TAT). Isotop ini mempunyai waktu paruh 10 hari dan membuatnya jauh lebih memadai untuk terapi radiasi daripada 213 (waktu paruh 46 menit). Tidak hanya 225 itu sendiri, tetapi juga para kerabatnya, memancarkan partikel alfa yang membunuh sel kanker dalam tubuh. Kesulitan utama penerapan 225Ac adalah injeksi intravena kompleks aktinium sederhana menghasilkan akumulasi dalam tulang dan hati untuk periode sepuluh tahun. Alhasil, setelah sel kanker mati oleh partikel alfa dari 225, radiasi dari aktinium dan kerabatnya dapat memicu mutasi baru. Untuk memecahkan masalah ini, 225Ac diikatkan ke zat pengkhelat, seperti sitrat, asam etilendiamintetraasetat (EDTA) atau asam dietilena triamina pentaasetat (DTPA). Ini mengurangi akumulasi aktinium dalam tulang, tetapi ekskresi dari tubuh tetap lambat. Hasil yang jauh lebih baik diperoleh dengan zat pengkhelat seperti HEHA (asam 1,4,7,10,13,16-heksaazasikloheksadekana-N,N',N'`,N'``,N'``',N'``'`-heksaasetat)[43] atau DOTA (asam 1,4,7,10-tetraazasiklododekana-1,4,7,10-tetraasetat) yang dikopling ke trastuzumab, suatu antibodi monoklonal yang berinterferensi dengan reseptor HER2/neu. Pemberian kombinasi yang disebut terakhir diujikan pada tikus dan terbukti efektif melawan leukemia, limfoma, kanker payudara, indung telur, neuroblastoma, dan kanker prostat.[44][45][46] 227 dengan waktu paruh menengah (21,77 tahun) membuatnya sebagai isotop radioaktif yang sangat cocok dalam pemodelan percampuran vertikal lambat air laut. Proses terkait tidak dapat dipelajari dengan akurasi yang diperlukan menggunakan pengukuran langsung kecepatan arus (dengan order 50 meter per tahun). Namun, evaluasi konsentrasi profil kedalaman untuk isotop yang berbeda memungkinkan memperkirakan laju pencampuran. Fisika di balik metode ini adalah sebagai berikut: air laut mengandung 235 yang terdispersi homogen. Produk peluruhannya, {{chem2|231|Pa]], mengendap secara gradual pada dasar laut, sehingga konsentrasinya pertama-tama meningkat tajam dan kemudian bertahan hingga hampir konstan. 231 meluruh menjadi 227; namun, konsentrasinya tidak mengikuti profil kedalaman 231, tetapi malah meningkat di dasar samudra. Hal ini terjadi karena proses pencampuran menambah 227 dari dasar laut. Sehingga, analisis profil kedalaman 231 dan 227 memungkinkan pemodelan perilaku pencampuran.[47][48] Tindakan pencegahan227 sangat radioaktif dan percobaan yang menggunakannya harus dilakukan dalam laaboratorium yang dirancang khusus dan dilengkapi dengan kotak sarung tangan. Ketika actinium triklorida diberikan secara intravena pada tikus, sekitar 33% aktinium disimpan di dalam tulang dan 50%nya dalam liver. Toksisitasnya sebanding dengan, sedikit lebih rendah, americium dan plutonium.[49] Untuk jumlah renik, sungkup asam (fume hood) dengan aerasi yang baik sudah memadai; untuk jumlah gram, diperlukan sel panas berperisai untuk melindungi radiasi gamma intensif yang dipancarkan oleh 227.[50] Lihat jugaReferensi
Bibliografi
Pranala luar
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||





![{\displaystyle {\ce {^{226}_{88}Ra + ^1_0n -> ^{227}_{88}Ra ->[\beta^-][42.2 \ {\ce {min}}] ^{227}_{89}Ac}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2468d2b1fea58f49113b2ae13ace50edffd021d6)
